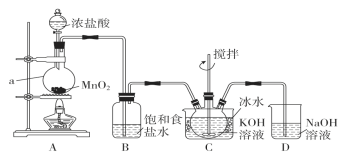
题目内容
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、CO32-、SO42-、Cl-。现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量KOH溶液加热后,收集到气体0.08 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。
根据上述实验,以下推测正确的是
A.Na+一定存在
B.100 mL溶液中含0.01 mol CO32-
C.Cl-一定存在
D.Ba2+一定不存在,Mg2+可能存在
【答案】A
【解析】
根据题意,Ba2+和SO42﹣可发生离子反应生成BaSO4沉淀,因此两者不能大量共存,Ba2+和CO32﹣可发生离子反应生成BaCO3沉淀,因此两者也不能大量共存。
第一份加入AgNO3溶液有沉淀产生,可能发生Cl﹣+Ag+═AgCl↓、CO32﹣+2Ag+═Ag2CO3↓、SO42﹣+2Ag+═Ag2SO4↓,所以可能含有Cl﹣、CO32﹣、SO42﹣中的至少一种;
第二份加足量KOH溶液加热后,收集到气体0.08mol,能和KOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+(Mg2+可以和OH﹣反应生产氢氧化镁沉淀),故可确定一定含有NH4+,一定不存在Mg2+。根据反应NH4++OH﹣![]() NH3↑+H2O,产生NH3为0.08mol,可得NH4+也为0.08mol;
NH3↑+H2O,产生NH3为0.08mol,可得NH4+也为0.08mol;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g,部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32﹣+Ba2+═BaCO3↓、SO42﹣+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解,因此溶液中一定存在CO32﹣、SO42﹣,一定不存在Ba2+;由条件可知BaSO4为4.66g,物质的量为0.02mol,SO32﹣物质的量浓度为:![]() =0.2mol/L,BaCO3为12.54g﹣4.66g═7.88g,物质的量为0.04mol,则CO32﹣物质的量为0.04mol,CO32﹣物质的量浓度为
=0.2mol/L,BaCO3为12.54g﹣4.66g═7.88g,物质的量为0.04mol,则CO32﹣物质的量为0.04mol,CO32﹣物质的量浓度为![]() =0.4mol/L;
=0.4mol/L;
由上述分析可得,溶液中一定存在CO32﹣、SO42﹣、NH4+,一定不存在Mg2+、Ba2+.而CO32﹣、SO42﹣、NH4+物质的量分别为0.04mol、0.02mol、0.08mol,CO32﹣、SO42﹣所带负电荷分别为0.04mol×2、0.02mol×2,共0.12mol,NH4+所带正电荷为0.08mol,所以一定含有钠离子,钠离子的物质的量最小是0.04mol,氯离子不能确定。
A. 由分析可知Na+一定存在,故A正确;
B. 100mL溶液中含0.04mol碳酸根离子,故B错误;
C. 氯离子是否存在无法确定,故C错误;
D. Mg2+、Ba2+一定不存在,故D错误;
正确答案是A。

 名校课堂系列答案
名校课堂系列答案【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极![]() 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加![]() 据此回答问题:
据此回答问题:
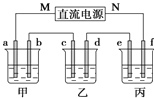
(1)电源的M端为_____________极;
(2)电极d上发生的电极反应式为__________; 乙池溶液PH__________填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________;
(5)若利用丙池实现铁上镀铜,则“e-f-x”![]() 溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯![]() 结构式为
结构式为![]() 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由![]() 和
和![]() 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为![]() 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
化学键 |
|
|
|
|
键能 | 243 | a | 607 | 630 |
当![]() 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)