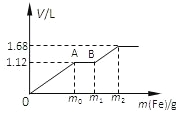
题目内容
【题目】下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为____________
(2)⑦的黄绿色单质的化学式为____________⑩的单质在常温下的存在状态为____________
(3)①的气态氢化物的水溶液显_______
(4)用电子式表示②与④形成化合物的过程______
(5)这些元素中的最高价氧化物对应的水化物中,碱性最强的是__呈两性的是__
(6)写出⑤与盐酸反应的化学方程式:__________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:______
【答案】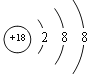 Cl2 液体 碱 Si
Cl2 液体 碱 Si ![]() KOH Al (OH)3 2Al+6HCl=2AlCl3+3H2↑ Al (OH)3+OH-=AlO2-+2H2O
KOH Al (OH)3 2Al+6HCl=2AlCl3+3H2↑ Al (OH)3+OH-=AlO2-+2H2O
【解析】
由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br。
(1)以上元素中只有Ar的最外层电子数为8,性质不活泼,最稳定,其原子结构示意图为: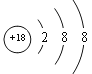 ;
;
(2)由分析可知⑦为Cl,其黄绿色单质的化学式为Cl2;⑩为Br,其单质Br2在常温下的存在状态为:液态;
(3)①为N,其氢化物为NH3,溶于水生成一水合铵,一水合铵电离出氢氧根离子,溶液显碱性;⑥的元素符号为Si;
(4)②与④形成的化合物为MgF2,为离子化合物,其电子式为,所以MgF2的形成过程是:![]() ;
;
(5)以上元素中最高价氧化物对应的水化物中碱性最强的为KOH,呈两性的氢氧化物为Al(OH)3;
(6)⑤为Al,与盐酸反应生成氯化铝和氢气,方程式为:2Al+6HCl=2AlCl3+3H2↑;⑤的氢氧化物为Al (OH)3,与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al (OH)3+OH-=AlO2-+2H2O。

【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极![]() 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加![]() 据此回答问题:
据此回答问题:
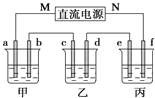
(1)电源的M端为_____________极;
(2)电极d上发生的电极反应式为__________; 乙池溶液PH__________填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________;
(5)若利用丙池实现铁上镀铜,则“e-f-x”![]() 溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯![]() 结构式为
结构式为![]() 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由![]() 和
和![]() 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为![]() 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
化学键 |
|
|
|
|
键能 | 243 | a | 607 | 630 |
当![]() 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)