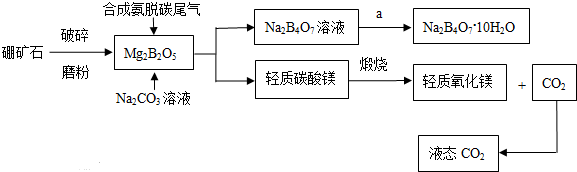
题目内容
15. 铝、铁及其化合物在工业生产中有着重要的应用.
铝、铁及其化合物在工业生产中有着重要的应用.(1)0.1mol•L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中离子浓度由大到小的顺序为c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-).
(2)某新型离子交换剂的组成为MgaAlb(OH)cCld•xH2O,其中a,b,c,d的定量关系式为2a+2b=c+2d-b.
(3)将Fe3O4投入滴有淀粉度液的HI溶液中,溶液变蓝色,反应的离子方程式为Fe3O4+8H++2I-=3Fe2++I2+4H2O.
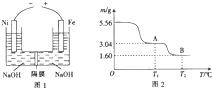
(4)在NaOH浓溶液中用电化学方法来制备Na2FeO4的原理如图1所示,则阳极的电极反应式为Fe-6e-+OH-=FeO42-+4H2O,阴极上观察到的现象是有无色气体生成.
(5)图2是绿矾(FeSO4•7H2O)受热分解所得固体产物的质量随温度变化的曲线,A处所得物质的化学式为FeSO4,A到B过程中发生反应的化学方程式为2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
分析 (1)硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中,铵根离子水解显酸性,亚铁离子水解液显酸性,所以相互抑制,氮铵根离子浓度大于亚铁离子;
(2)化合物中正负化合价的代数和为0;
(3)将Fe3O4投入滴有淀粉度液的HI溶液中,溶液变蓝色,四氧化三铁溶于酸生成亚铁盐和铁盐,铁离子具有氧化性能氧化碘离子生成碘单质,遇到淀粉变蓝;
(4)装置图可知Fe做阳极,铁失电子在碱溶液中生成高铁酸根离子,Ni做阴极,溶液中氢离子得到电子发生还原反应;
(5)5.56g绿矾相物质的量=$\frac{5.56g}{278g/mol}$=0.02mol,含有0.14mol结晶水质量=0.14mol×18g/mol=2.52g,当温度为t1时,晶体共失重5.56-3.04=2.52g,正好全部是结晶水的质量,由此可知温度为t1时绿矾完全失水得到FeSO4,B点固体的质量1.60g,加热过程中铁元素不会损失,化合物B中氧元素的质量为:1.60-0.02×56=0.48g,相当于0.03mol,因此可得固体B的化学式为Fe2O3,硫酸亚铁分解生成氧化铁、二氧化硫、三氧化硫;
解答 解:(1)硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中,铵根离子水解显酸性,亚铁离子水解液显酸性,所以相互抑制,氮铵根离子浓度大于亚铁离子,溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
故答案为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
(2)MgaAlb(OH)c(CO3)d•xH2O中,正负化合价的代数和为0,则(+2)×a+(+3)×b+(-1)×c+(-2)×d=0,解得2a+3b=c+2d,2a+2b=c+2d-b;
故答案为:c+2d-b;
(3)四氧化三铁溶于酸生成亚铁盐和铁盐,铁离子具有氧化性能氧化碘离子生成碘单质,遇到淀粉变蓝,反应的离子方程式为:Fe3O4+8H++2I-=3Fe2++I2+4H2O;
故答案为:Fe3O4+8H++2I-=3Fe2++I2+4H2O;
(4)装置图可知Fe做阳极,铁失电子在碱溶液中生成高铁酸根离子,电极反应为:Fe-6e-+8OH-=FeO42-+4H2O,Ni做阴极,溶液中氢离子得到电子发生还原反应,电极反应为:2H2O+2e-=H2+2OH-,有无色气体生成;
故答案为:Fe-6e-+8OH-=FeO42-+4H2O,有无色气体生成;
(5)5.56g绿矾相物质的量=$\frac{5.56g}{278g/mol}$=0.02mol,含有0.14mol结晶水质量=0.14mol×18g/mol=2.52g,当温度为t1时,晶体共失重5.56-3.04=2.52g,正好全部是结晶水的质量,由此可知温度为t1时绿矾完全失水得到FeSO4,B点固体的质量1.60g,加热过程中铁元素不会损失,化合物B中氧元素的质量为:1.60-0.02×56=0.48g,相当于0.03mol,因此可得固体B的化学式为Fe2O3,所以A到B发生化学反应的方程式应为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
故答案为:FeSO4,2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
点评 本题考查了电解质溶液中离子浓度大小,氧化还原反应离子方程式书写,电解池原理的应用,图象分析计算方法的理解应用,掌握基础是关键,题目难度中等.

| A. | C2H6O | B. | C3H8O | C. | C3H6BrCl | D. | C4H9Cl |
| A. | 1mol Na2O和Na2O2的混合物中,阴阳离子总数为3NA | |
| B. | 非标准状况下,NA个CO2分子所占的条件不可能为22.4L | |
| C. | 24.4gNa2O•SiO2中含有0.2NA个SiO2分子 | |
| D. | 56gFe投入1000mL3.5mol•L-1稀硝酸中,充分反应,转移电子总数为3NA |
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:
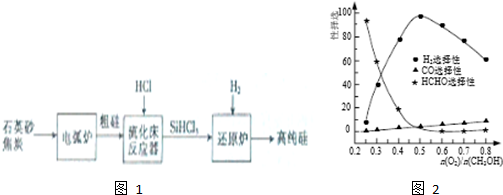
①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |