题目内容
【题目】化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
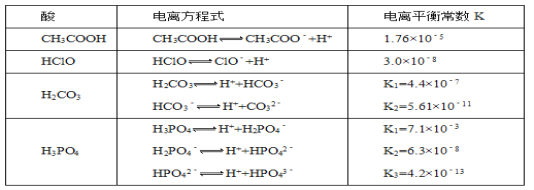
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___________(填化学式,下同),最弱的是_________________
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__________________________,1.2molL﹣1的NaClO溶液pH=__________________________(已知:lg2=0.3)。
(3)求出该温度下,0.10molL﹣1的CH3COOH溶液中的c(H+)=____________molL﹣1。
【答案】H3PO4 HPO42 CO2+ClO+H2O═HClO+HCO3 10.8 1.33×103
【解析】
(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,则它们酸性强弱顺序是:![]() ,所以酸性最强的是
,所以酸性最强的是![]() ,最弱的是
,最弱的是![]() ;
;
(2)因为酸性:![]() ,碳酸的酸性强于次氯酸,所以反应的离子方程式为:
,碳酸的酸性强于次氯酸,所以反应的离子方程式为:![]() ═
═![]() ;
;
1.2mol/L的NaClO溶液中水解离子方程式为:![]()
![]() ,Kh=
,Kh=![]() =
=![]() =
=![]() =
=![]() ×10-6,由于ClO-的水解程度较小,所以c(HClO)≈c(OH-),c(HClO)≈1.2mol/L,则c(OH-)=
×10-6,由于ClO-的水解程度较小,所以c(HClO)≈c(OH-),c(HClO)≈1.2mol/L,则c(OH-)=![]() =2×10-3.5mol/L,
=2×10-3.5mol/L,![]() mol/L,pH=-lg(5×10-11.5)=10.8;
mol/L,pH=-lg(5×10-11.5)=10.8;
(3)该温度下,0.1mol/L的CH3COOH溶液中存在电离平衡CH3COOH![]() ,平衡常数
,平衡常数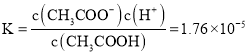 ,由于电离程度较小,c(CH3COO-)≈c(H+),c(CH3COOH)≈0.1mol/L,
,由于电离程度较小,c(CH3COO-)≈c(H+),c(CH3COOH)≈0.1mol/L,![]() ,c(H+)=1.33×10-3mol/L。
,c(H+)=1.33×10-3mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素在周期表中的位置为__。
(2)NH3的电子式为__。
(3)下列事实能说明Y 元素的非金属性比S 元素的非金属性强的是__。
a.Y 单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)常温下,碳与镁形成的 1 mol 化合物Q 与水反应,生成2 mol Mg(OH)2和 1 mol 气态烃,该烃中碳氢质量比为 9:1。写出化合物Q 与水反应的化学方程式:__。