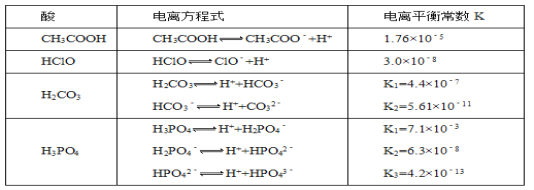
题目内容
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是

A.H+由阳极区向阴极区迁移
B.阳极电极反应:2HCl + 2e- == Cl2 + 2H+
C.阴极电极反应:Fe3+ + e- == Fe2+
D.阴极区发生的反应有:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
【答案】B
【解析】
在电源的右侧,HCl(g)→Cl2(g),该过程是失电子的过程,故该侧为阳极,电极反应为:2HCl-2e-=2H++Cl2,电源的左侧为阴极,电极反应为:Fe3++e-=Fe2+;此外,根据物质的循环,还可以推出阴极区域还会进行反应:4Fe2++O2+4H+=4Fe3+ +2H2O。
A、H+在电源的右侧产生,在电源的左侧被消耗,右侧为阳极,左侧为阴极,即H+由阳极区向阴极区迁移,A正确;
B、阳极发生氧化反应,是失去电子的过程,电极反应为:2HCl-2e-=2H++Cl2,B错误;
C、阴极发生还原反应,是得到电子的过程,电极反应为:Fe3++e-=Fe2+,C正确;
D、根据图中的循环,可以推出阴极区域会进行反应:4Fe2++O2+4H+=4Fe3+ +2H2O,D正确;
故选B。

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目