题目内容
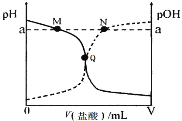
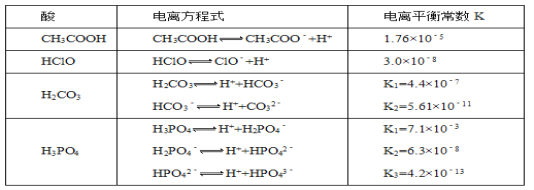
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
【答案】B
【解析】
根据化学反应速率的数学表达式,以及图表进行分析;
4~8min的反应物浓度差△c=10μmol·L-1,△t为4min,因此4~8min间的平均反应速率为2.5μmol·L-1·min-1,图中从0min开始到8min反应物浓度降低为原来的1/4,根据这一幅度,可以推测从8min到第16min应该也降低为8min时的1/4,即由10μmol·L-1降低到2.5μmol·L-1,因此推测第16min反应物的浓度故为2.5μmol·L-1,故B正确;
答案选B。

练习册系列答案
相关题目