题目内容
【题目】铬是一种重要的金属元素,具有多种价态,单质铬是硬度最大的金属,熔点为![]() 。回答下列问题:
。回答下列问题:
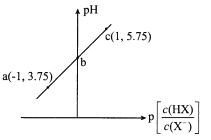
![]() 工业上以铬铁矿
工业上以铬铁矿![]() 主要成分是
主要成分是![]() 为原料冶炼铬的流程如图所示:
为原料冶炼铬的流程如图所示:
![]() 中铬元素的化合价为_________。
中铬元素的化合价为_________。
![]() 高温氧化时发生反应的化学方程式为________________。
高温氧化时发生反应的化学方程式为________________。
![]() 操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
![]() 是两性氢氧化物,请写出其电离方程式_________________。
是两性氢氧化物,请写出其电离方程式_________________。
![]() 铬元素能形成含氧酸及含氧酸盐,若测得浓度为
铬元素能形成含氧酸及含氧酸盐,若测得浓度为![]() 的铬酸
的铬酸![]() 溶液中含铬元素的微粒浓度分别为
溶液中含铬元素的微粒浓度分别为![]() 、
、![]() 、
、![]() ,试推测
,试推测![]() 溶液呈________
溶液呈________![]() 填“酸”“碱”或“中”
填“酸”“碱”或“中”![]() 性,原因是______________。
性,原因是______________。
![]() 水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
![]() 电解处理含有
电解处理含有![]() 的污水:用铁作电极电解污水,
的污水:用铁作电极电解污水,![]() 被阳极区生成的离子还原成
被阳极区生成的离子还原成![]() ,生成的
,生成的![]() 与阴极区生成的
与阴极区生成的![]() 结合生成
结合生成![]() 沉淀而除去。则阴极上的电极反应式为_______,若要处理
沉淀而除去。则阴极上的电极反应式为_______,若要处理![]() 浓度为
浓度为![]() 的污水,理论上需要消耗_______kg的铁。
的污水,理论上需要消耗_______kg的铁。
![]() 转化为有价值的产品磁性铁铬氧体
转化为有价值的产品磁性铁铬氧体![]() :先向含
:先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气![]() 氧化部分
氧化部分![]() 并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被
在酸性条件下被![]() 还原为
还原为![]() 的离子方程式__________,若处理含
的离子方程式__________,若处理含![]() 不考虑其他含铬微粒
不考虑其他含铬微粒![]() 的污水时恰好消耗
的污水时恰好消耗![]() ,则当铁铬氧体中
,则当铁铬氧体中![]() 时,铁铬氧体的化学式为_______________。
时,铁铬氧体的化学式为_______________。
【答案】![]()
![]() 灼烧使
灼烧使![]() 分解
分解 ![]() 酸 在溶液里
酸 在溶液里![]() 第一步完全电离,则
第一步完全电离,则![]() 在溶液里只电离,不水解,
在溶液里只电离,不水解,![]() 电离出
电离出![]() 而使溶液呈酸性
而使溶液呈酸性 ![]() 或者
或者![]()
![]()
![]()
![]() 。
。
【解析】
1)①根据化合物中各元素的正负化合价代数和为0分析。
②根据流程确定反应物和生成物,用化合价升降法配平书写化学方程式。③由流程![]() →Cr和铝热反应逆推。
→Cr和铝热反应逆推。
(2)模仿Al (OH)3与NaOH、 稀硫酸的反应确定电离产生的离子。
(3)①在阴极H+放电,根据电子守恒和原子守恒计算。
②根据化合价升降法配平书写离子方程式,根据原子守恒和电荷守恒确定化学式。
铬铁矿中加入碳酸钠并通入氧气,高温下将![]() 氧化得到
氧化得到![]() 、
、![]() ,同时生成
,同时生成![]() ,将得到的固体溶于水得到
,将得到的固体溶于水得到![]() 溶液;
溶液;
![]() 中Fe元素化合价为
中Fe元素化合价为![]() 价、O元素化合价为
价、O元素化合价为![]() 价,根据化合物中各元素化合价代数和为0得铬元素的化合价为
价,根据化合物中各元素化合价代数和为0得铬元素的化合价为![]() 价;故答案为
价;故答案为![]() ;
;
![]() 高温氧化时,
高温氧化时,![]() 和碳酸钠、氧气发生氧化还原反应生成
和碳酸钠、氧气发生氧化还原反应生成![]() 、二氧化碳和氧化铁,该反应中Fe元素化合价由
、二氧化碳和氧化铁,该反应中Fe元素化合价由![]() 价变为
价变为![]() 价、Cr元素化合价由
价、Cr元素化合价由![]() 价变为
价变为![]() 价,O元素化合价由0价变为
价,O元素化合价由0价变为![]() 价,所以氧气是氧化剂、
价,所以氧气是氧化剂、![]() 是还原剂,依据原子守恒、转移电子守恒配平书写化学方程式为
是还原剂,依据原子守恒、转移电子守恒配平书写化学方程式为![]() ;故答案为:
;故答案为:![]() ;
;
![]() 操作a中
操作a中![]() 首先分解生成氧化铬,氧化铬再和Al反应生成铬,所以操作a由两种均发生了化学反应的过程构成,其分别是
首先分解生成氧化铬,氧化铬再和Al反应生成铬,所以操作a由两种均发生了化学反应的过程构成,其分别是![]() 分解和铝热反应;故答案为:灼烧使
分解和铝热反应;故答案为:灼烧使![]() 分解;
分解;
![]() 为两性氢氧化物,能发生酸式电离和碱式电离,电离方程式为
为两性氢氧化物,能发生酸式电离和碱式电离,电离方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 溶液呈酸性,原因是在溶液里
溶液呈酸性,原因是在溶液里![]() 第一步完全电离,则
第一步完全电离,则![]() 在溶液里只电离,不水解,
在溶液里只电离,不水解,![]() 电离出
电离出![]() 而使溶液呈酸性;故答案为:酸;在溶液里
而使溶液呈酸性;故答案为:酸;在溶液里![]() 第一步完全电离,则
第一步完全电离,则![]() 在溶液里只电离,不水解,
在溶液里只电离,不水解,![]() 电离出
电离出![]() 而使溶液呈酸性;
而使溶液呈酸性;
![]() 根据题目叙述可知,阴极生成氢氧根离子,所以阴极电极反应式是:
根据题目叙述可知,阴极生成氢氧根离子,所以阴极电极反应式是:![]() 或者
或者![]() ,
,![]() 的
的![]() 的物质的量为10mol,
的物质的量为10mol,![]() 被还原需要转移6mol电子,总共转移60mol电子,因为
被还原需要转移6mol电子,总共转移60mol电子,因为![]() 被
被![]() 氧化生成
氧化生成![]() ,每一个
,每一个![]() 失去1个电子,根据电子守恒需要
失去1个电子,根据电子守恒需要![]() ,也就需要60molFe,即
,也就需要60molFe,即![]() ,故答案为:
,故答案为:![]() 或者
或者![]() ;
;![]() ;
;
![]() 被氧化,化合价由
被氧化,化合价由![]() 价
价![]() 价,化合价升高1价,
价,化合价升高1价,![]() 中Cr的化合价由
中Cr的化合价由![]() 价
价![]() 价,化合价降低3价,最小公倍数为3,离子方程式为:
价,化合价降低3价,最小公倍数为3,离子方程式为: ![]() ;
;
根据铁元素守恒,求出溶液中![]() 的物质的量为6mol,
的物质的量为6mol,![]() 的物质的量为4mol,根据化合价代数和为0,求出氧原子物质的量为
的物质的量为4mol,根据化合价代数和为0,求出氧原子物质的量为![]() ,因此铁铬氧体的化学式为
,因此铁铬氧体的化学式为![]() ;
;
故答案为: ![]() ;
;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质。
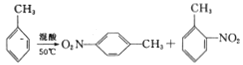 (反应明显放热)
(反应明显放热)
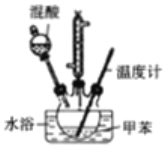
实验中可能用到的数据:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g。
(1)在烧杯中配制该实验所需混酸的方法是___。
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和___。
(3)分离产物的方案如下:
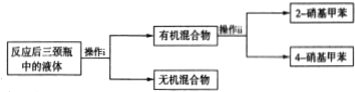
回答下列问题:
操作ii中会用到下列仪器中的___(填序号)。
a.温度计 b.蒸发皿 c.锥形瓶 d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为___。
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000molL-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg。
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该___。
②设计简单实验证明滤渣已经洗涤干净:___。
③原无机混合物中HNO3的浓度为___molL-1(用含V和W的代数式表示)。