题目内容
20.运用元素周期律分析下面的推断,其中不正确的是( )| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | Mg(OH)2的碱性比Al(OH)3的碱性强 |
分析 A.元素的金属性越强,对应的单质与水反应越剧烈;
B.根据同主族元素的性质相似性分析;
C.根据同主族元素的性质的相似性和递变性分析;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.金属性:Na>Li,元素的金属性越强,对应的单质与水反应越剧烈,则钠与水反应比锂与水反应剧烈,故A错误;
B.卤族元素的单质从上到下颜色逐渐加深,则砹(At)为有色固体,卤族元素单质的卤化银(除AgF)都不溶于水也不溶于硝酸,故B正确;
C.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故C正确;
D.金属性:Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则Mg(OH)2的碱性比Al(OH)3的碱性强,故D正确.故选A.
点评 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
10.下列离子方程式正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O--→2C6H5OH+CO32- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
11.有关如图所示化合物的说法不正确的是( )
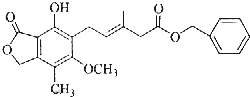

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与4molNaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
5.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HNO3═NaNO3+H2O |



