题目内容
10.下列离子方程式正确的是( )| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O--→2C6H5OH+CO32- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
分析 A.用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时电解质溶液中还生成NaOH;
B.银氨溶液和乙醛发生银镜反应生成乙酸铵、银、氨和水;
C.苯酚钠和二氧化碳反应生成碳酸氢钠和苯酚;
D.二者发生氧化还原反应生成硫酸根离子、锰离子.
解答 解:A.用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时电解质溶液中还生成NaOH,离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-,故A错误;
B.银氨溶液和乙醛发生银镜反应生成乙酸铵、银、氨和水,离子方程式为CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故B错误;
C.苯酚钠和二氧化碳反应生成碳酸氢钠和苯酚,离子方程式为CO2+H2O+C6H5O--→C6H5OH+HCO3-,故C错误;
D.二者发生氧化还原反应生成硫酸根离子、锰离子,离子方程式为5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及离子方程式书写规则是解本题关键,注意有些化学反应与反应物的量、反应物浓度等因素有关,易错选项是C,生成碳酸氢钠与二氧化碳的量无关,为易错点.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
20.含手性碳原子的分子称手性分子,手性分子具有光学活性.如下图有机物具有光学活性(式中标有*号的为手性碳原子),该有机物发生下列哪种反应后,产生物仍然一定具有光学活性( )


| A. | 银镜反应 | B. | 水解反应 | C. | 消去反应 | D. | 酯化反应 |
1.在一定温度下,可逆反应A(气)+3B(气)?2C(气)达到平衡的标志是( )
| A. | 2v正(A)=v正(C) | |
| B. | 单位时间内生成n摩A,同时生成3n摩B | |
| C. | A、B、C的浓度不再变化 | |
| D. | A、B、C的分子数之比为1:3:2 |
18.SiO2是一种化工原料,可以制备一系列物质(见图).下列说法错误的是( )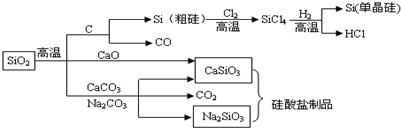

| A. | 图中所有的反应中,属于氧化还原反应的有3个 | |
| B. | 用硫酸可以除去石英砂(主要成分是SiO2)中少量的碳酸钙 | |
| C. | 工业制水泥、工业制玻璃、燃煤固硫等都用到原料石灰石 | |
| D. | 纯净的二氧化硅和单晶硅都是信息产业的重要基础原料,高纯度二氧化硅的广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
5.下列过程中化学反应速率的加快对人类有益的是( )
| A. | 金属的腐蚀 | B. | 食物的腐败 | C. | 塑料的老化 | D. | 氨的合成 |
15.下列说法中正确的是( )
| A. | 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| D. | 离子化合物中一定含有离子键 |
2.下列混合物,不论它们以何种比例混合,只要总质量一定,经完全燃烧后产生二氧化碳和水的量也一定的是( )
| A. | 乙炔和乙苯 | B. | 甲烷和乙烷 | ||
| C. | 乙醛和丙酮 | D. | 乙酸和乳酸[CH3CH(OH)COOH] |
20.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | Mg(OH)2的碱性比Al(OH)3的碱性强 |
 ,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
 .
. .
.