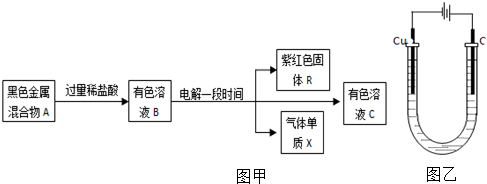
题目内容
15.写出下列反应的化学方程式:①SO2通入溴水中SO2+Br2+2H2O=H2SO4+2HBr
②SO2通入黄褐色FeCl3溶液中,在加热条件下可使溶液变浅绿色2FeCl3+SO2+2H2O=FeSO4+FeCl2+4HCl
③高温条件下,碳酸钙与二氧化硅反应CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑
④SiO2与烧碱溶液反应:SiO2+2NaOH=Na2SiO3+H2O.
分析 ①二氧化硫与溴水发生氧化还原反应生成硫酸和溴化氢;
②三价铁有氧化性,二氧化硫有还原性;
③碳酸钙与二氧化硅反应生成硅酸钙和二氧化碳;
④SiO2是酸性氧化物,与烧碱溶液反应生成盐和水.
解答 解:①溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应生成硫酸和HBr,溶液中溴的颜色会褪去,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
②三价铁有氧化性,二氧化硫有还原性,二者之间发生氧化还原反应,即2FeCl3+SO2+2H2O=FeSO4+FeCl2+4HCl,故答案为:2FeCl3+SO2+2H2O=FeSO4+FeCl2+4HCl;
③在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应生成硅酸钙和二氧化碳,其反应方程式为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;故答案为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
④SiO2是酸性氧化物,与烧碱溶液反应生成硅酸钠和水,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O.
点评 本题考查了化学方程式的书写,题目难度中等,明确化学反应的实质是解题的关键,注意掌握化学方程式的书写原则,试题侧重考查学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.下列过程中化学反应速率的加快对人类有益的是( )
| A. | 金属的腐蚀 | B. | 食物的腐败 | C. | 塑料的老化 | D. | 氨的合成 |
3.下列化合物中阴阳离子半径之和最大的离子化合物是( )
| A. | NaF | B. | NaCl | C. | SO2 | D. | CaCl2 |
10.X,Y都是短周期元素,X原子的最外层上有4个电子,Y原子的最外层上有6个电子,则X与Y形成化合物的化学式可能为( )
| A. | XY2 | B. | X2Y4 | C. | YX2 | D. | XY |
20.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | Mg(OH)2的碱性比Al(OH)3的碱性强 |
7.下列关于硫酸盐的化学式、俗称、用途都正确的是( )
| A. | 重晶石 BaSO4 钡餐 | B. | 明矾 KAlSO4•12H2O 净水剂 | ||
| C. | 绿矾 Fe2(SO4)3•7H2O 补血剂 | D. | 生石膏 2CaSO4•H2O 石膏绷带 |
5.下列关于浓硫酸的叙述中,错误的是( )
| A. | 浓硫酸滴在纸上使纸变黑,是由于浓硫酸有脱水性 | |
| B. | 稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断用玻璃棒搅拌 | |
| C. | 欲除去CO2中的水蒸气,可将气体通过盛有浓硫酸的洗气瓶 | |
| D. | 不慎在皮肤上沾上少量浓硫酸时,应立即用大量水冲洗 |
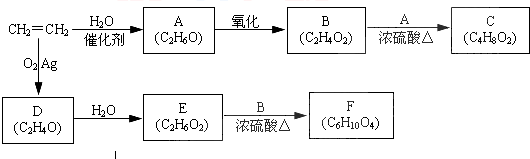
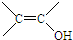 、
、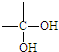 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为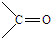
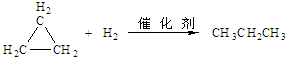
 .
.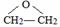 .
.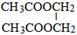 .
.