题目内容
12.将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为( )| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
分析 在密度容器中,在相同温度下,气体的物质的量之比等于压强之比,若气体充分混合,可发生:SO2+2H2S=3S+2H2O;NH3+HCl=NH4Cl,结合反应的方程式计算反应后气体的物质的量,可计算混和后容器中的压强与原容器中的压强之比.
解答 解:SO2+2H2S=3S+2H2O,NH3+HCl=NH4Cl,如果把容器的体积认为是2V,四个容器的体积为8V,那么各气体充分混合后,只剩余体积为V的SO2,所以,混合后容器中的压强与原容器中的压强之比为1:8,故选D.
点评 本题考查化学方程式的计算,难度不大,注意把握相关物质的性质以及可能发生的反应,根据反应判断反应后容器内的气体,为解答该题的关键.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
2.下列混合物,不论它们以何种比例混合,只要总质量一定,经完全燃烧后产生二氧化碳和水的量也一定的是( )
| A. | 乙炔和乙苯 | B. | 甲烷和乙烷 | ||
| C. | 乙醛和丙酮 | D. | 乙酸和乳酸[CH3CH(OH)COOH] |
3.下列化合物中阴阳离子半径之和最大的离子化合物是( )
| A. | NaF | B. | NaCl | C. | SO2 | D. | CaCl2 |
20.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | Mg(OH)2的碱性比Al(OH)3的碱性强 |
7.下列关于硫酸盐的化学式、俗称、用途都正确的是( )
| A. | 重晶石 BaSO4 钡餐 | B. | 明矾 KAlSO4•12H2O 净水剂 | ||
| C. | 绿矾 Fe2(SO4)3•7H2O 补血剂 | D. | 生石膏 2CaSO4•H2O 石膏绷带 |
17. A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
(1)A在元素周期表中的位置是第3周期ⅡA族;A与E形成的化合物的电子式是 .
.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
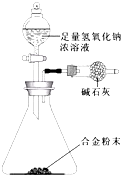
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
1.工业上以铝土矿(主要成分是Al2O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下:
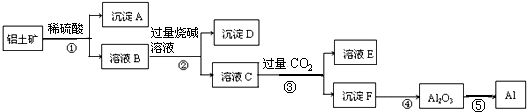
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 沉淀A主要是SiO2 | B. | 步骤②的目的是分离Fe3+和Al3+ | ||
| C. | 溶液E溶质主要有碳酸钠和硫酸钠 | D. | ⑤主要是把电能转化为化学能 |
2.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据如表:
则下列说法正确的是( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.009 mol |