题目内容
8.将一定量的S02和含0.7mol氧气的空气(忽略C0)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2$?_{△}^{催化剂}$2SO3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收02,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是bcd.(填字母)
a.S02和S03浓度相等 b.S02百分含量保持不变
c.容器中气体的压强不变 d.S02的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是b.(填字母)
a.向装置中再充入N2 b.向装置中再充入02
c.改变反应的催化剂 d.升高温度
(3)该反应达到平衡时S02的转化率94.7%(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀10.5克.
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)该反应是一个反应前后气体体积减小的放热反应,欲提高SO2的转化率,则改变条件使平衡向正反应方向移动;
(3)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,根据剩余氧气的量计算参加反应的氧气的量,根据参加反应的氧气的量计算参加反应的二氧化硫、三氧化硫的量,二氧化硫和三氧化硫混合气体体积减去三氧化硫的量就是未参加反应的二氧化硫的量,再根据转化率公式计算;
(4)结合硫原子守恒计算.
解答 解:(1)a.可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化硫的起始浓度以及转化率有关,故错误;
b.可逆反应达到平衡状态时,各物质的百分含量不变,SO2百分含量保持不变,说明到达平衡状态,故正确;
c.随反应进行气体的物质的量减小,恒温恒容下,容器内气体压强减小,当容器中气体的压强不变,说明到达平衡状态,故正确;
d.SO2的生成速率与SO2的消耗速率相等,说明到达平衡状态,故正确;
e.混合气体的质量不变,容器的体积不变,所以密度始终不变,不能说明到达平衡状态,故错误;
故选bcd;
(2)a.向装置中再充入N2,反应物和生成物的浓度不变,平衡不移动,所以不能提高转化率,故错误;
b.向装置中再充入O2,氧气浓度增大,平衡向正反应方向移动,提高了二氧化硫的转化率,故正确;
c.改变反应的催化剂只改变反应速率,不改变平衡,所以不能提高二氧化硫的转化率,故错误;
d.升高温度,平衡向逆反应方向移动,降低了二氧化硫的转化率,故错误;
故选b;
(3)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,所以三氧化硫和未参加反应的二氧化硫的体积是21.28L,剩余氧气的体积是5.6L,则参加反应的氧气的体积=0.7mol×22.4L/mol-5.6L=10.08L,根据二氧化硫、三氧化硫和氧气的关系式知,参加氧化还原反应的二氧化硫的体积=10.08L×2=20.16L,生成三氧化硫的体积=10.08L×2=20.16L,则未参加氧化还原反应的二氧化硫的体积=21.28L-20.16L=1.12L,原来二氧化硫的体积=20.16L+1.12L=21.28L,所以二氧化硫的转化率=$\frac{20.16L}{21.28L}$×100%=94.7%,故答案为:94.7%.
(4)能和氯化钡溶液反应生成沉淀的物质只有三氧化硫,若将平衡混合气体的5%通入过量的BaCl2溶液,能和氯化钡溶液反应的三氧化硫的物质的量是$\frac{20.16L}{22.4L/mol}$×5%=0.045mol,根据硫原子守恒知,硫酸钡的质量=0.045mol×233g/mol=10.5g,
故答案为:10.5.
点评 本题考查平衡状态的判断、影响化学平衡的因素等知识点,对于反应前后气体的计量数之和不相等的可逆反应来说,可从浓度、温度、颜色、压强、百分含量等角度判断是否达到平衡状态,难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案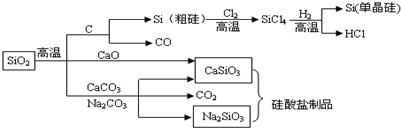
| A. | 图中所有的反应中,属于氧化还原反应的有3个 | |
| B. | 用硫酸可以除去石英砂(主要成分是SiO2)中少量的碳酸钙 | |
| C. | 工业制水泥、工业制玻璃、燃煤固硫等都用到原料石灰石 | |
| D. | 纯净的二氧化硅和单晶硅都是信息产业的重要基础原料,高纯度二氧化硅的广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| A. | 阴、阳离子通过静电吸引所形成的化学键,叫离子键 | |
| B. | 活泼金属元素与活泼非金属元素化合时,形成的是离子键 | |
| C. | 某元素最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键 | |
| D. | 全部由非金属元素组成的化合物可能是离子化合物 |
| A. | NaF | B. | NaCl | C. | SO2 | D. | CaCl2 |
| A. | 氯气 | B. | 二氧化硫 | C. | 活性炭 | D. | 硫化氢 |
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | Mg(OH)2的碱性比Al(OH)3的碱性强 |
 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
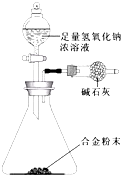
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
| A. | 都易溶于水 | B. | 水溶液都显碱性 | C. | 都能与盐酸反应 | D. | 加热都能分解 |
 ,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
 .
. .
.