题目内容
18.下列说法不正确的是( )| A. | 等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量不相等 | |
| B. | 淀粉水解的最终产物在加热条件下可与新制氢氧化铜反应生成砖红色沉淀 | |
| C. | 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| D. | 2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热可生成甲基丙烯 |
分析 A、乙醛和乙酸乙酯的最简式均为CH2O;
B、淀粉水解的最终产物为葡萄糖,含-CHO;
C、饱和碳酸钠可与乙酸反应,并降低乙酸乙酯的溶解度;
D、2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热会发生消去反应,据此回答.
解答 解:A、乙醛和乙酸乙酯的最简式均为CH2O,等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量相等,故A正确;
B、淀粉水解的最终产物为葡萄糖,含-CHO,具有还原性,加热条件下与新制氢氧化铜反应生成砖红色沉淀,故B正确;
C、饱和碳酸钠可与乙酸反应,并降低乙酸乙酯的溶解度,则可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,故C正确;
D、2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热会发生消去反应,可生成2-甲基-1-丙烯,故D错误.
故选D.
点评 本题考查较综合,涉及有机物的性质、混合物的分离提纯、有机反应等,侧重淀粉、乙酸的性质及乙醛和乙酸乙酯组成的考查,题目难度不大

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
8.下列说法中正确的是( )
| A. | 两个原子或多个原子之间的相互作用叫化学键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| D. | 离子化合物中一定含有离子键 |
9.醋酸是重要的一元酸,在有机和无机反应中都有应用.
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:由表中数据推测,数值x的范围是1.57<x<1.76.
(2)现有25℃时,pH=3的醋酸.请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$将减小(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH>7(填“>”“<”或“=”),用离子方程式解释其原因CH3COO-+H2O?CH3COOH+OH-.
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
④当醋酸的浓度为0.1mol/L时,此时醋酸的电离常数约为1×10-5.
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:由表中数据推测,数值x的范围是1.57<x<1.76.
| 反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
| 1 | 2 | 2 | 1.33 |
| 2 | 3 | 2 | 1.57 |
| 3 | 4 | 2 | x |
| 4 | 5 | 2 | 1.76 |
①若向醋酸中加入少量醋酸钠固体,此时溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$将减小(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH>7(填“>”“<”或“=”),用离子方程式解释其原因CH3COO-+H2O?CH3COOH+OH-.
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
④当醋酸的浓度为0.1mol/L时,此时醋酸的电离常数约为1×10-5.
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 断裂旧化学键吸收的总能量小于形成新化学键放出的总能量 |
13.科技文献中常出现下列词汇,其中与相关物质的颜色无关联的是( )
| A. | 绿色食品 | B. | 白色污染 | C. | 棕色烟气 | D. | 赤潮 |
3.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
| A. | ②③两步都是氧化还原反应 | B. | 只有第②步是氧化还原反应 | ||
| C. | 该方法对生产设备基本没有腐蚀 | D. | 该方法对环境污染较小 |
10.在以下性质的比较中,正确的是( )
| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
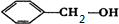 .
. A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题: