题目内容
2. A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:(1)A、B、C的电负性由小到大的顺序为C<N<O;D的稳定离子核外有10种运动状态的电子.
(2)A的最高价氧化物对应的水化物分子中其中心原子采取sp2杂化.
(3)已知A、C形成的化合物分子甲与B的单质分子结构相似,1mol甲中含有π键的数目为2NA(或1.204×1024).
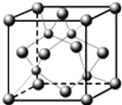
(4)科学家发现硼化D在39K时呈超导性,在硼化D晶体的理想模型中,D原子和硼原子是分层排布的,一层D一层硼相间排列.如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是D原子投影,黑球是硼原子投影,图中的硼原子和D原子投影在同一平面上.根据图示确定硼化D的化学式为MgB2.
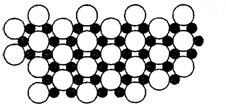
(5)E的外围电子排布式是3d104s1;E的氢化物的晶体结构如右所示,此氢化物化学式是CuH;写出此氢化物在氯气中燃烧的化学方程式2CuH+3Cl2点燃_点燃–––––2CuCl2+2HCl.
分析 A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,A的原子序数需要B,则A原子核外电子排布为1s22s22p2,为C元素;C是地壳中含量最高的元素,所以C是O元素;D原子的s电子与p电子数相等,其原子序数大于C,则其核外电子排布式为:1s22s22p63s2,故D为Mg元素;E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,为29号Cu元素,据此进行解答.
解答 解:A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,A的原子序数需要B,则A原子核外电子排布为1s22s22p2,为C元素;C是地壳中含量最高的元素,所以C是O元素;D原子的s电子与p电子数相等,其原子序数大于C,则其核外电子排布式为:1s22s22p63s2,故D为Mg元素;E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,为29号Cu元素,
(1)A、B、C为同一周期元素,同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素的第一电离能从小到大顺序是C<O<N;D为Mg元素,其稳定离子为镁离子,镁离子核外的电子总数为10,则镁离子核外含有10种运动状态的电子,
故答案为:C<O<N;10;
(2)A为C元素,其最高价氧化物对应水化物为H2CO3,H2CO3中C原子最外层电子数全部成键,没有孤电子对,成1个C=O双键,2个C-O单键,杂化轨道数目为3,采取sp2杂化,
故答案为:sp2;
(3)C、O形成的化合物分子甲与N的单质分子结构相似,1mol氮气分子中含有2molπ键,所以1mol甲中含有π键的数目为2NA(或1.204×1024),
故答案为:2NA(或1.204×1024);
(4)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为1313;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为1616,由此可知Mg、B原子数之比为:1616:1313=1:2,故硼化镁的化学式为MgB2,
故答案为:MgB2;
(5)E为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,则其外围电子排布式为:3d104s1;
该晶胞中铜离子和氢离子个数比是1:1,所以其化学式为CuH,氯气有强氧化性,氢化亚铜有强还原性,氯气能把氢化亚铜氧化生成氯化铜和氯化氢,所以氢化亚铜在氯气中燃烧的方程式为:2CuH+3Cl2点燃_点燃–––––2CuCl2+2HCl,
故答案为:3d104s1; CuH; 2CuH+3Cl2点燃_点燃–––––2CuCl2+2HCl.
点评 本题考查了位置、结构与性质的关系、晶胞的计算,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力,注意掌握晶胞计算的方法与技巧,明确元素周期表结合、元素周期律的内容.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量不相等 | |
| B. | 淀粉水解的最终产物在加热条件下可与新制氢氧化铜反应生成砖红色沉淀 | |
| C. | 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| D. | 2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热可生成甲基丙烯 |
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
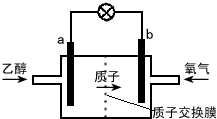
| A. | a极为电池的负极,该电极发生氧化反应 | |
| B. | 电池工作时电子由a极流出沿导线经灯泡到b极 | |
| C. | 电池正极的电极反应式为 O2+2H2O+4e-═4OH- | |
| D. | 电池工作时,1mol乙醇被氧化转移12mol电子 |
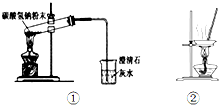
| A. | 用图①所示装置做碳酸氢钠固体受热分解实验 | |
| B. | 用装置②蒸干氯化镁溶液制MgCl2•6H2O | |
| C. | 锥形瓶可用作加热的反应器,滴定时不得用待测溶液润洗 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏低 |
| A. | HBr、Cu(OH)2、BaSO4 | B. | NaOH、Ca(OH)2、NH3•H2O | ||
| C. | HClO、NaF、Ba(OH)2 | D. | NH4Cl、CH3COONa、Na2S |
| A. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 通入少量HCl气体,溶液中pH值增大 | |
| D. | 加入水时,平衡向逆反应方向移动 |
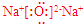
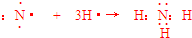 .
.