题目内容
10.在以下性质的比较中,正确的是( )| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
分析 A.电子层数越大,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
B.同一族元素从上到下,第一电离逐渐减小;
C.根据分子的空间结构分析;
D.叁键的键能大于双键的键能,双键的键能大于单键.
解答 解:A.电子层数越大,半径越大,K+具有三个电子层,半径最大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:K+>O2->F->Na+,故A错误;
B.同一族元素从上到下,第一电离逐渐减小,则第一电离能:He>Ne>Ar,故B错误;
C.CH4为正四面体,键角为109°28′,H2O为V形,键角为105°,CO2为直线形,键角为180°,则分子中的键角:CO2>CH4>H2O,故C错误;
D.叁键的键能大于双键的键能,双键的键能大于单键,所以共价键的键能:C-C<C=C<C≡C,故D正确;
故选D.
点评 本题考查微粒性质的比较,涉及离子半径、键能、键角、键长的比较等,涉及知识点较多,注重高频考点的考查,注意归纳规律性知识,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列说法正确的是( )
| A. |  如图可表示水分解过程中的能量变化 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g)△H=-a kJ/mol, Ⅱ: 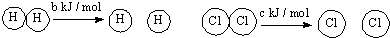 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c |
1.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都属于离子型碳化物.请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
| A. | ZnC2水解生成乙烷 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙炔 | D. | Li2C2水解生成乙烯 |
18.下列说法不正确的是( )
| A. | 等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量不相等 | |
| B. | 淀粉水解的最终产物在加热条件下可与新制氢氧化铜反应生成砖红色沉淀 | |
| C. | 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| D. | 2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热可生成甲基丙烯 |
15.有机物A的结构简式为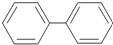 ,它的二氯代物共有几种(不考虑空间立体异构)( )
,它的二氯代物共有几种(不考虑空间立体异构)( )
 ,它的二氯代物共有几种(不考虑空间立体异构)( )
,它的二氯代物共有几种(不考虑空间立体异构)( )| A. | 10种 | B. | 11种 | C. | 12种 | D. | 15种 |
2.下列叙述正确的是( )
| A. | 原子晶体的熔点一定比金属晶体的高 | |
| B. | 分子晶体的熔点一定比金属晶体的低 | |
| C. | 晶体内部的微粒按一定规律周期性的排列 | |
| D. | 凡有规则外形的固体一定是晶体 |
14.下列实验装置与叙述正确的是( )
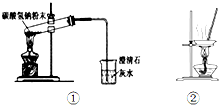

| A. | 用图①所示装置做碳酸氢钠固体受热分解实验 | |
| B. | 用装置②蒸干氯化镁溶液制MgCl2•6H2O | |
| C. | 锥形瓶可用作加热的反应器,滴定时不得用待测溶液润洗 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏低 |