题目内容
3.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
| A. | ②③两步都是氧化还原反应 | B. | 只有第②步是氧化还原反应 | ||
| C. | 该方法对生产设备基本没有腐蚀 | D. | 该方法对环境污染较小 |
分析 2NaCl+H2SO4═Na2SO4+2HCl↑为难挥发性酸制取易挥发性酸,没有元素的化合价变化;
Na2SO4+4C═Na2S+4CO↑中C元素的化合价升高,S元素的化合价降低;
Na2S+CaCO3═Na2CO3+CaS中,没有元素的化合价变化,以此来解答.
解答 解:A.只有②中含元素的化合价变化,是氧化还原反应,故A错误;
B.只有②中含元素的化合价变化,是氧化还原反应,故B正确;
C.该方法中,酸对设备有腐蚀作用,故C错误;
D.该方法生成有毒气体CO,且HCl易挥发,对环境造成污染,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及物质的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13.同周期的X、Y、Z三种元素的最高价氧化物对应水化物分别是:H3XO4、H2YO4、HZO4,下列判断正确的是( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4.
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4.
| A. | ①② | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
14.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 2 mol/L盐酸与锌反应时,用锌粉代替锌粒,生成氢气的速率不变 | |
| B. | 对于反应2CO+2NO?N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,反应速率减慢 | |
| D. | 用铁片和稀硫酸反应制取氢气时,将稀硫酸改为浓硫酸可以加快生成氢气的速率 |
11.锌-溴蓄电池的充、放电的电池总反应为Zn+Br2$?_{充电}^{放电}$Zn2++2Br-,下列各反应:①Zn-2e-=Zn2+;②Br2+2e-=2Br-;③2Br--2e-=Br2;④Zn2++2e-=Zn,其中充电的阳极和放电的负极的反应分别是( )
| A. | ①② | B. | ③② | C. | ④② | D. | ③① |
18.下列说法不正确的是( )
| A. | 等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量不相等 | |
| B. | 淀粉水解的最终产物在加热条件下可与新制氢氧化铜反应生成砖红色沉淀 | |
| C. | 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| D. | 2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热可生成甲基丙烯 |
15.有机物A的结构简式为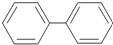 ,它的二氯代物共有几种(不考虑空间立体异构)( )
,它的二氯代物共有几种(不考虑空间立体异构)( )
 ,它的二氯代物共有几种(不考虑空间立体异构)( )
,它的二氯代物共有几种(不考虑空间立体异构)( )| A. | 10种 | B. | 11种 | C. | 12种 | D. | 15种 |
12.下列说法不正确的是( )
| A. | 铝原子核外有13种不同运动状态的电子 | |
| B. | 前四周期元素中,基态原子中成对电子数与其所在周期数相同的元素有6种 | |
| C. | 第一电离能介于B、N之间的第二周期元素有3种 | |
| D. | HF的水溶液中存在4种氢键 |
7.新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为C2H5OH+3O2═2CO2+3H2O.下列说法不正确的是( )
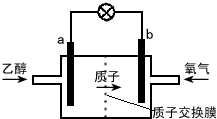

| A. | a极为电池的负极,该电极发生氧化反应 | |
| B. | 电池工作时电子由a极流出沿导线经灯泡到b极 | |
| C. | 电池正极的电极反应式为 O2+2H2O+4e-═4OH- | |
| D. | 电池工作时,1mol乙醇被氧化转移12mol电子 |
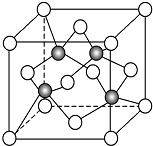 碳及其化合物与人类关系密切
碳及其化合物与人类关系密切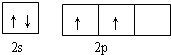 ,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.
,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.