题目内容
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 断裂旧化学键吸收的总能量小于形成新化学键放出的总能量 |
分析 A.依据反应后醋酸凝固,说明反应是吸热反应;
B.吸热反应把能量转化为产物内部能量;
C.依据反应前后能量守恒分析判断;
D.反应为吸热反应.
解答 解:A.醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B.因反应为吸热反应,即吸热的热量转化为产物内部的能量,故B正确;
C.因反应为吸热反应,则反应后生成物的总能量高于反应物的总能量,故C错误;
D.反应为吸热反应,从化学键的角度分析,化学键断裂要吸收能量,化学键形成要放出能量,则应有化学键断裂吸收的总能量大于化学键形成放出的总能量,故D错误;
故选B.
点评 本题考查化学反应能量变化判断,热化学方程式书写方法,能量守恒的应用分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列关于物质用途的说法正确的是( )
| A. | SO2可用来漂白馒头、银耳等食品 | |
| B. | 纯净的二氧化硅是制备光导纤维的原料 | |
| C. | 氢氧化铝可以用做耐火材料 | |
| D. | 四氧化三铁常用作红色油漆和涂料 |
14.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 2 mol/L盐酸与锌反应时,用锌粉代替锌粒,生成氢气的速率不变 | |
| B. | 对于反应2CO+2NO?N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,反应速率减慢 | |
| D. | 用铁片和稀硫酸反应制取氢气时,将稀硫酸改为浓硫酸可以加快生成氢气的速率 |
1.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都属于离子型碳化物.请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
| A. | ZnC2水解生成乙烷 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙炔 | D. | Li2C2水解生成乙烯 |
11.锌-溴蓄电池的充、放电的电池总反应为Zn+Br2$?_{充电}^{放电}$Zn2++2Br-,下列各反应:①Zn-2e-=Zn2+;②Br2+2e-=2Br-;③2Br--2e-=Br2;④Zn2++2e-=Zn,其中充电的阳极和放电的负极的反应分别是( )
| A. | ①② | B. | ③② | C. | ④② | D. | ③① |
18.下列说法不正确的是( )
| A. | 等质量的乙醛和乙酸乙酯完全燃烧时消耗氧气的量不相等 | |
| B. | 淀粉水解的最终产物在加热条件下可与新制氢氧化铜反应生成砖红色沉淀 | |
| C. | 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| D. | 2-氯-2-甲基丙烷在氢氧化钠的醇溶液中加热可生成甲基丙烯 |
15.有机物A的结构简式为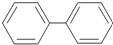 ,它的二氯代物共有几种(不考虑空间立体异构)( )
,它的二氯代物共有几种(不考虑空间立体异构)( )
 ,它的二氯代物共有几种(不考虑空间立体异构)( )
,它的二氯代物共有几种(不考虑空间立体异构)( )| A. | 10种 | B. | 11种 | C. | 12种 | D. | 15种 |
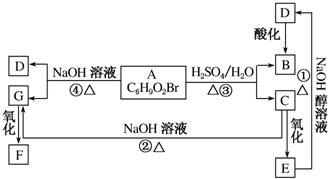 有机物A、B、C、D、E、F、G相互关系如图所示.已知F分子中含有两个相同的官能团,5.2gF能与100mL1mol•L-1的NaOH溶液恰好完全中和.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G相互关系如图所示.已知F分子中含有两个相同的官能团,5.2gF能与100mL1mol•L-1的NaOH溶液恰好完全中和.D的分子式为C3H3O2Na,E的分子中含有羧基.
 .
.