题目内容
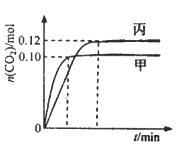
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
容器 | 温度/℃ | 起始物质的量浓度/mol·L-1 | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T1 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率大于40%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)>v(逆)
【答案】BD
【解析】
A.由题图可知,甲先达到化学平衡状态,所以T1>T2,升高温度,平衡时CO2的物质的量减小,说明反应逆向进行,故该正反应为放热反应,A项错误;
B.T1℃时,甲容器中达到平衡状态时CO2的物质的量为0.1mol,
2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量 0.1 0.1 0 0
转化量 0.05 0.05 0.025 0.05
平衡量 0.05 0.05 0.025 0.05
则平衡常数![]() 则乙容器中N2(g)+2CO2(g)
则乙容器中N2(g)+2CO2(g) ![]() 2NO(g)+2CO(g)的平衡常数为0.1;当N2的转化率为40%,此时转化的N2为0.04mol/L,依此算出其它物质的转化量:
2NO(g)+2CO(g)的平衡常数为0.1;当N2的转化率为40%,此时转化的N2为0.04mol/L,依此算出其它物质的转化量:
N2(g)+2CO2(g) ![]() 2NO(g)+2CO(g)
2NO(g)+2CO(g)
起始量 0.10 0.20 0 0
转化量 0.04 0.08 0.08 0.08
剩余量 0.06 0.12 0.08 0.08
此时浓度商Qc=![]() <0.1,所以反应继续向右进行,因此N2的转化率大于40%,B项正确;
<0.1,所以反应继续向右进行,因此N2的转化率大于40%,B项正确;
C.从所给数据“凑一边”后可以看出,乙容器中的气体相当于甲容器中气体的2倍,由于是恒容容器,相当于恒压情况下达平衡后再压回原体积,由于增大压强时平衡向右移动,气体的物质的量减小,所以乙中压强小于甲容器的2倍,C项错误;
D.丙容器中反应达到平衡后,再充入0.10molNO和0.10molCO2,相当于增大压强,平衡正向移动,此时正反应速率大于逆反应速率,D项正确;
答案选BD。

【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
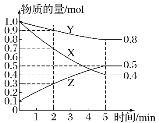
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。