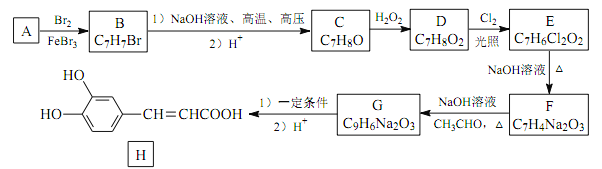
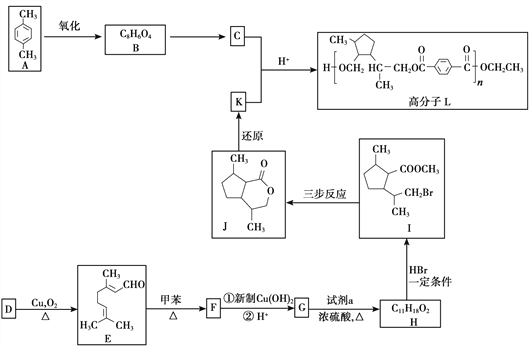
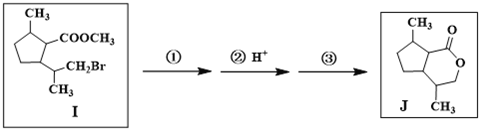
题目内容
【题目】常温时,体积均为50mL物质的量浓度均为0.10mol/L的HX、HY、HZ三种弱酸,分别用0.10mol/L的NaOH溶液滴定,滴定曲线如图所示。下列有关说法错误的是
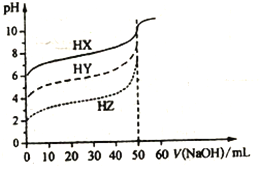
A. 浓度均为0.10mol/L时,酸的电离度:HX<HY<HZ
B. pH均为3.0的三种酸加水稀释至pH均为6.5,加入水的量:HX>HY>HZ
C. 图中当均滴入50mLNaOH溶液时,所得溶液中水的电离程度:HX>HY>HZ
D. 用NaOH溶液中和pH与体积均相等的三种酸时,消耗n(NaOH):HX<HY<HZ
【答案】D
【解析】A. 相同浓度的这三种酸,酸的pH越大,说明酸的电离程度越小,酸的酸性越弱,由滴定曲线图可知,浓度均为0.10mol/L的三种酸HX、HY、HZ的pH分别为6、4、2,故酸性大小为![]() ,A正确;B.由 pH均为3.0加水稀释至pH均为6.5,则酸性越弱的酸加水的量越多,所以加入水的量:HX>HY>HZ,B正确;C. 当均滴入50mLNaOH溶液时,刚好生成NaX、NaY、NaZ,对应的酸,酸性越弱,酸根离子的水解程度越大,水的电离程度越大,因此所得溶液中水的电离程度:HX>HY>HZ,C正确;D.当pH相等时,酸性越弱,酸的浓度越大,因此用NaOH溶液中和pH与体积均相等的三种酸,消耗n(NaOH):HX>HY>HZ,D错误;答案选D.
,A正确;B.由 pH均为3.0加水稀释至pH均为6.5,则酸性越弱的酸加水的量越多,所以加入水的量:HX>HY>HZ,B正确;C. 当均滴入50mLNaOH溶液时,刚好生成NaX、NaY、NaZ,对应的酸,酸性越弱,酸根离子的水解程度越大,水的电离程度越大,因此所得溶液中水的电离程度:HX>HY>HZ,C正确;D.当pH相等时,酸性越弱,酸的浓度越大,因此用NaOH溶液中和pH与体积均相等的三种酸,消耗n(NaOH):HX>HY>HZ,D错误;答案选D.

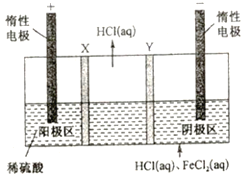
【题目】实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图: 
(1)①写出铜帽溶解过程中铜发生反应的化学方程式 . ②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是 .
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下: 2Cu2++4I﹣=2CuI(白色)↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
①滴定选用的指示剂为 , 滴定终点观察到的现象为 .
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
完全沉淀的pH | 3.2 | 8.8 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0molL﹣1HNO3、1.0molL﹣1 NaOH.
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量 , 使其充分反应
②向反应后的溶液中滴加1.0moLL﹣1的NaOH溶液,调节溶液的pH范围为;
③过滤;
④向滤液中滴加1.0moLL﹣1的氢氧化钠,调节pH范围为;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. 
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: . ②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.