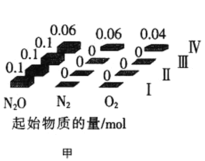
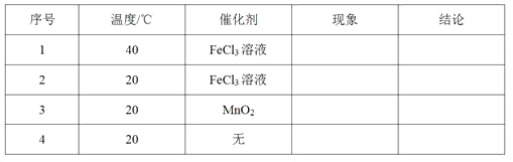
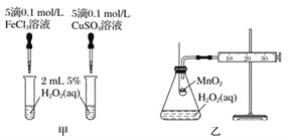
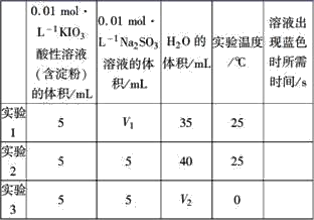
题目内容
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1) N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为______。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-=2NO2-+H2O;2NO2+2OH-=NO3-+NO2-+H2O;
①下列措施能提高尾气中NO和NO2去除率的有______(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是______(填化学式);吸收后排放的尾气中含量较高的氮氧化物是______(填化学式)。
【答案】2NH3+2O2 ![]() N2O+3H2O BC NaNO3 NO
N2O+3H2O BC NaNO3 NO
【解析】
(1)NH3与O2在加热和催化剂作用下生成N2O,类似于生成NO的反应,同时生成水;
(2)NO2与NaOH反应生成亚硝酸钠、硝酸钠和水,NO和NO2一起与氢氧化钠反应生成亚硝酸钠和水,据此书写方程式;
①提高尾气中NO和NO2去除率,应是气体与氢氧化钠溶液充分接触而反应;
②反应生成NaNO2和NaNO3;如NO的含量比NO2大,则尾气中含有NO。
(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O,根据得失电子守恒和原子守恒可知反应有水生成,配平化学方程式,得反应的化学方程式为2NH3+2O2 ![]() N2O+3H2O;
N2O+3H2O;
(2)NO2与NaOH反应生成亚硝酸钠、硝酸钠和水,NO和NO2一起与氢氧化钠反应生成亚硝酸钠和水,反应离子方程式为:2NO2+2OH-=NO2-+NO3-+H2O、NO+NO2+2OH-=2NO2-+H2O;
①A. 加快通入尾气的速率,气体不能充分反应,不能提高尾气中NO和NO2的去除率,A不符合题意;
B. 采用气、液逆流的方式吸收尾气,可使气液充分接触,能提高尾气中NO和NO2的去除率,B符合题意;
C. 定期补充适量的NaOH溶液可增大反应物浓度,能提高尾气中NO和NO2的去除率,C符合题意;
故合理选项是BC;
②反应生成NaNO2和NaNO3,则含有的杂质为NaNO3,如NO的含量比NO2大,则尾气中含有NO。