题目内容
【题目】下列各组热化学方程式中,ΔH1>ΔH2的是( )
①C(s)+O2(g)=CO2(g) ΔH1;C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(g)+O2(g)==SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2
③H2(g)+![]() O2(g)=H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
O2(g)=H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①
B.②③④
C.③④
D.①②③
【答案】C
【解析】
①碳不完全燃烧放热少;焓变比较要包含负号比较大小;故ΔH1<ΔH2,故①错误;
②固体硫变为气态硫需要吸收热量;故ΔH1<ΔH2,故②错误;
③相同条件下量少的反应放热少;1mol氢气燃烧放热小于2 mol氢气燃烧放热,故ΔH1>ΔH2,故③正确;
④碳酸钙分解吸热,焓变为正值;氧化钙和水化合反应放热,焓变是负值;所以ΔH1>ΔH2,故④正确;
答案选C。

【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
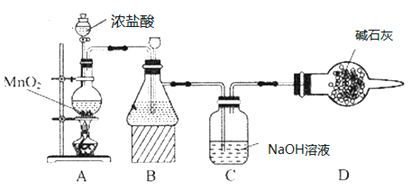
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
【题目】现以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计)。
加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
pH | 1.00 | 2.28 | 3.30 | __ | 7.00 | 9.70 | __ | 11.70 | 12.50 |
(1)请利用表的数据绘制滴定曲线_____。
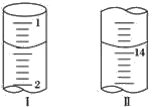
(2)如果初读数和末读数如图所示,滴定液的用量为__mL。