题目内容
【题目】N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)![]() CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O![]() FeO++N2;则第二步为____________________(写化学方程式)。
FeO++N2;则第二步为____________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_________(填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
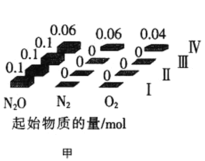
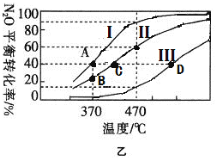
①该反应的△H_____0(填“>”或“<”)。
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_________。B点对应的平衡常数k=________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 _______________。
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
【答案】FeO++CO![]() Fe++CO2 大于 > 0.0005 mol·L-1·s-1 0.0044 D>C>A 向逆反应方向
Fe++CO2 大于 > 0.0005 mol·L-1·s-1 0.0044 D>C>A 向逆反应方向
【解析】
(1)将总反应减去第一步反应,可得第二步反应;第二步反应几乎不影响总反应达到平衡所用的时间,即第一步反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的活化能;
(2)①取同一条直线,分析温度对平衡的影响即可得到反应的热效应;
②v(O2)=![]() ,根据N2O的转化率可以计算出△n(O2),从而得v(O2);平衡常数只和温度有关,题中并未告知B点的容器体积,故需要通过计算A点的平衡常数;
,根据N2O的转化率可以计算出△n(O2),从而得v(O2);平衡常数只和温度有关,题中并未告知B点的容器体积,故需要通过计算A点的平衡常数;
③整个反应过程中,容器体积均不变,体系的总质量也不变,故体系的密度也不变,故分析370℃时,根据压强的影响判断出容器体积大小,从而可以比较各体系的密度大小;
④比较该温度下,容器IV中Qc和K的大小关系即可。
(1)将总反应减去第一步反应,可得第二步反应: FeO++CO![]() Fe++CO2;第二步反应几乎不影响总反应达到平衡所用的时间,即第一步反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的活化能;
Fe++CO2;第二步反应几乎不影响总反应达到平衡所用的时间,即第一步反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的活化能;
(2)①分析曲线I,温度升高,N2O的转化率增大,则该反应是吸热反应,即△H>0;
②容器I中,20s后反应达到平衡,则N2O的转化率为40%,即△n(N2O)=0.1mol×40%=0.04mol,则△n(O2)=0.02mol,v(O2)=![]() =0.0005mol·L-1·s-1;由于平衡常数只和温度有关,故B点的平衡常数和A点的平衡常数相同,A点,c(N2O)=
=0.0005mol·L-1·s-1;由于平衡常数只和温度有关,故B点的平衡常数和A点的平衡常数相同,A点,c(N2O)=![]() =0.03mol/L,c(N2)=
=0.03mol/L,c(N2)=![]() =0.02mol/L,c(O2)=
=0.02mol/L,c(O2)=![]() =0.01mol/L,则K=
=0.01mol/L,则K=![]() =
=![]() =0.0044;
=0.0044;
③温度相同时,转化率:I>II>III,则压强:I<II<III,故体积I>II>III,由于这三个容器中的体系的总质量相同,故密度:I<II<III,在整个反应中,体系的质量、体积都不变,故密度也不变,即D>C>A;
④容器IV中,起始时,c(N2O)=![]() =0.06mol/L,c(N2)=
=0.06mol/L,c(N2)= ![]() =0.06mol/L,c(O2)=
=0.06mol/L,c(O2)=![]() =0.04mol/L,则Qc=
=0.04mol/L,则Qc=![]() =
=![]() =0.04>K,则起始时反应向逆反应方向移动。
=0.04>K,则起始时反应向逆反应方向移动。

【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
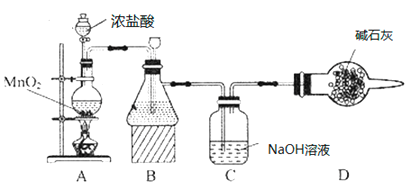
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)