题目内容
【题目】在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的I2可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
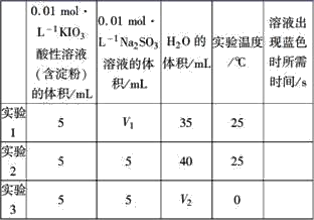
该实验的目的是_________;表中V2=_________。
【答案】探究该反应的反应速率与温度、浓度的关系 40
【解析】
(1)依据表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系;
(2)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,据此解答即可。
(1)实验1和实验2探究该反应速率与亚硫酸钠溶液浓度的关系,实验2和实验3探究该反应速率与温度的关系;由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。故该实验的目的是探究该反应的反应速率与温度、浓度的关系;
(2)由实验2可以看出混合液的总体积为50mL,故V1=50mL-35mL-5mL=10mL,V2=50mL-10mL=40mL。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目