题目内容
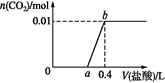
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
【答案】B
【解析】
A、此温度下c(NH4+)=c(NH2-)=1×10-15molL-1,则离子积K=c(NH4+)·c(NH2-)=1×10-30(molL-1)2,A错误;
B.根据A中分析可知B正确;
C.在液氨中加入NaNH2晶体,NH2-的浓度变大,平衡逆向移动,但温度不变K不变,C错误;
D、在液氨中加入NH4Cl晶体,则c(NH4+)将增大,温度不变K不变,D错误;
答案选B。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。