��Ŀ����
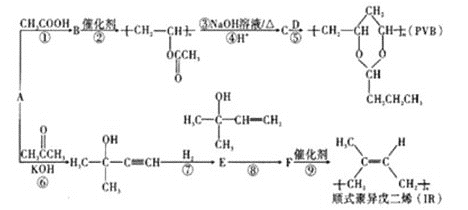
����Ŀ��A(C2H2)�ǻ����л�����ԭ�ϡ���A�Ʊ��߷��ӽ�������(PVB)��IR�ĺϳ�·��(���ַ�Ӧ������ȥ)��ͼ��ʾ��
��֪����RCHO+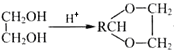 +H2O��
+H2O��
��RBr![]() RCOOH��
RCOOH��
�Իش��������⣺
��1�����̢ٵķ�Ӧ����Ϊ___��B�к��������ŵ�������___��
��2����Ӧ��Ļ�ѧ����ʽΪ___����Ӧ�۵Ļ�ѧ����ʽΪ___��
��3�����ڹ��̢ڣ�����˵����ȷ����___(�����)��
a.��Ӧ���������۷�Ӧ
b.���ɵĸ߷��ӻ����ﻹ������ˮ��Ӧ��ʹ����ɫ
c.�ø߷������ھ��к��䵥����ȫһ���Ľṹ
d.���ɵĸ߷��Ӳ��Ͼ��������ԣ���Ϊ�����
e.ͨ�������Dz�øø߷��ӵ�ƽ����Է�������Ϊ30444������֪��nԼΪ354
��4��F�����������___��ԭ�ӹ�ƽ�棬D�Ľṹ��ʽ��___��
��5��G��E��Ϊͬ���칹�壬��G������ͬ���칹���к���̼̼˫���Ľṹ(����E�����Ҳ�����˳���칹)����___�֡�(��֪̼̼˫�����ǻ�ֱ���������ȶ���������)
��6��������Ŀ��Ϣ������ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳɶ������Ҷ�����д���ϳ�·��___(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��
���𰸡��ӳɷ�Ӧ ���� 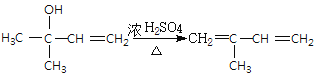 +H2O
+H2O 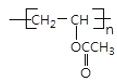 +nNaOH
+nNaOH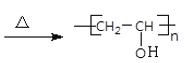 +nCH3COONa de 11 CH3CH2CH2CHO 26
+nCH3COONa de 11 CH3CH2CH2CHO 26 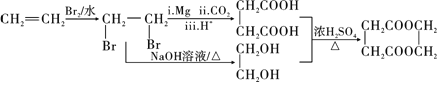
��������
�ɷ���ʽ��֪AΪCH��CH���ɸ߾���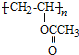 �Ľṹ����֪��Ȳ�����ᷢ���ӳɷ�Ӧ�õ�B����֪BΪCH2=CHOOCCH3����PVB�Ľṹ����֪
�Ľṹ����֪��Ȳ�����ᷢ���ӳɷ�Ӧ�õ�B����֪BΪCH2=CHOOCCH3����PVB�Ľṹ����֪![]() ����ˮ������CΪ
����ˮ������CΪ![]() ����DΪCH3CH2CH2CHO��CH��CH���ͪ��KOH�����·���̼��˫���ӳɷ�Ӧ������
����DΪCH3CH2CH2CHO��CH��CH���ͪ��KOH�����·���̼��˫���ӳɷ�Ӧ������![]() ���������������ӳɷ�Ӧ����
���������������ӳɷ�Ӧ����![]() ��F�ڴ��������µõ�˳ʽ�������ϩ
��F�ڴ��������µõ�˳ʽ�������ϩ![]()
![]()
![]() ����FΪCH2=C(CH3)CH=CH2����
����FΪCH2=C(CH3)CH=CH2����![]() ������ȥ��Ӧ����F��
������ȥ��Ӧ����F��
(1)���̢�����Ȳ�����ᷢ���ӳɷ�Ӧ����B(CH2=CHOOCCH3)��B�еĺ��������ŵ������ǣ�������
(2)��Ӧ��Ļ�ѧ����ʽΪ��![]()
![]() +H2O��
+H2O��
��Ӧ�۵Ļ�ѧ����ʽΪ��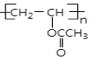 +nNaOH
+nNaOH![]()
![]() +nCH3COONa��
+nCH3COONa��
(3) a.��Ӧ�����ڼӾ۷�Ӧ��a����
b.�ø߷��Ӳ��ϲ���̼̼˫��������ˮ����Ӧ��b����
c.�ø߷�������û��̼̼˫�����䵥���к���̼̼˫�������Խṹ��ͬ��c����
d.���ɵĸ߷��Ӳ���Ϊ���ͽṹ�����������ԣ��ۺ϶Ȳ�ͬ�������ǻ���d��ȷ��
e.���ڵ���Է�������Ϊ86��ͨ�������Dz�øø߷��ӵ�ƽ����Է�������Ϊ30444������֪��n=![]() =354��e��ȷ��
=354��e��ȷ��
��ѡde��
(4)FΪCH2=C(CH3)CH=CH2������2��̼̼˫������̼̼˫��ֱ��������ԭ�Ӷ���ͬһ��ƽ���ϣ��������Ի���1��Hԭ����ͬһ��ƽ���ϣ���11���������Ϸ�����֪DΪCH3CH2CH2CHO��
(5)EΪ![]() ��G��E��Ϊͬ���칹�壬G������ͬ���칹���к���̼̼˫���Ľṹ����һ�������ſ���Ϊ�ǻ����Ѽ����纬���ǻ����ɿ���-OHȡ����ϩ��H��CH2=CH-CH2-CH2-CH3��CH3-CH=CH-CH2-CH3��CH2=C(CH3)CH2CH3��CH3C(CH3)=CHCH3��CH3CH(CH3)CH=CH2��̼̼˫�����ǻ�ֱ���������ȶ��������ǣ�-OH��ȡ����λ�ù���13�֣�
��G��E��Ϊͬ���칹�壬G������ͬ���칹���к���̼̼˫���Ľṹ����һ�������ſ���Ϊ�ǻ����Ѽ����纬���ǻ����ɿ���-OHȡ����ϩ��H��CH2=CH-CH2-CH2-CH3��CH3-CH=CH-CH2-CH3��CH2=C(CH3)CH2CH3��CH3C(CH3)=CHCH3��CH3CH(CH3)CH=CH2��̼̼˫�����ǻ�ֱ���������ȶ��������ǣ�-OH��ȡ����λ�ù���13�֣�
�纬���Ѽ�������ΪCH3-O-C4H7(8��)��CH3CH2-O-C3H5(3��)��CH3CH2CH2-O-CH=CH2��CH3C(CH3)-O-CH=CH2����13�֣����Ӧ��ͬ���칹�干26��
(6)���������Ҷ���������Ӧ�õ�Ŀ�����Ҫ���Ʊ����������Ҷ�������ϩ���巢���ӳɷ�Ӧ�õ�1��![]() �������飬1��
�������飬1��![]() �����������ˮ��õ��Ҷ����������Ϣ1��
�����������ˮ��õ��Ҷ����������Ϣ1��![]() ���������ڣ���Mg����CO2����H+�����µõ������ᣬ�ϳ�·������ͼΪ
���������ڣ���Mg����CO2����H+�����µõ������ᣬ�ϳ�·������ͼΪ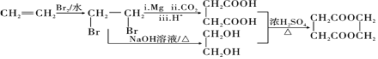 ��
��

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�����Ŀ����84����Һ����1984�걱��ijҽԺ����ʹ�ö����������ճ�������ʹ�ù㷺������Ч�ɷ���NaClO��ij��ѧ�о���ѧϰС����ʵ�����Ʊ�NaClO��Һ������������̽���ͳɷֲⶨ��
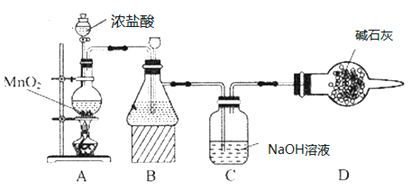
(1)��ѧϰС�鰴��ͼװ�ý���ʵ��(���ּг�װ��ʡȥ)����Ӧһ��ʱ��ֱ�ȡB��Cƿ�е���Һ����ʵ�飬ʵ���������±���
ʵ�鲽�� | ʵ������ | |
Bƿ | Cƿ | |
ʵ��1��ȡ�����μ���ɫʯ����Һ | ��죬����ɫ | ����������ɫ |
ʵ��2���ⶨ��Һ��pH | 3 | 12 |
��֪���ٱ���NaClO��ҺpHΪ11����25��Cʱ��������볣��Ϊ��H2CO3��K1=4.4��10-7��K2=4.7��10-11��HClO��K=3��10-8���ش��������⣺
��װ��Bʢװ���Լ���___________��װ��A�з�����Ӧ�����ӷ���ʽ__________��
��Cƿ��Һ�е�������NaCl��__________(�ѧʽ)��
������Cƿ��Һ����NaHCO3��Һ�������������������ʵ�飬Cƿ����Ϊ��ʵ��1����ɫʯ����Һ������ɫ��ʵ��2��Cƿ��Һ��pH=7�����ƽ���ƶ�ԭ��������ɫʯ����Һ������ɫ��ԭ��______
(2)�ⶨCƿ��Һ��NaClO����(��λ��g/L)��ʵ�鲽�����£�
��.ȡCƿ��Һ20mL����ƿ�У����������ữ���������KI��Һ���ǽ�ƿ�����ڰ�����ַ�Ӧ��
��.��0.1000mol/LNa2S2O3����Һ�ζ���ƿ�е���Һ��������Һ��ʾ�յ���ظ�����2��3�Σ�Na2S2O3��Һ��ƽ������Ϊ24.00mL��(��֪��I2+2S2O32-=2I-+S4O62-)
�ٲ���I����ƿ�з�����Ӧ�����ӷ���ʽΪ_________��
�ڵζ����յ������_____________��
��Cƿ��Һ��NaClO����Ϊ______g/L(����2λС��)