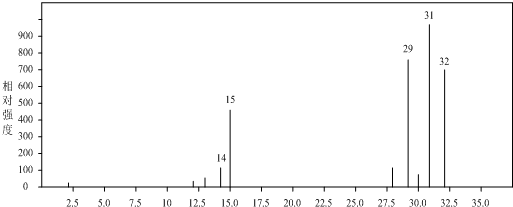
题目内容
19.短周期主族元素X、Y、W、R的原子序数依次增大.X的最高正价与最低负价的代数和为0,X、Y同周期,Y、R同主族,且R原子的最外层电子数是其电子层数的2倍,W的正二价阳离子与氖原子具有相同的核外电子排布.下列说法中正确的是( )| A. | X有多种气态氢化物 | B. | 原子半径:R>W | ||
| C. | 气态氢化物的热稳定性:R>Y | D. | 最高价氧化物的水化物的酸性:X>R |
分析 X、Y、W、R是原子序数依次增大的短周期主族元素,W的正二价阳离子与氖原子具有相同的核外电子排布,则W为Mg元素;R原子的最外层电子数是其电子层数的2倍,原子序数大于Mg,处于第三周期,最外层电子数为6,故R为S元素;Y、R同主族,则Y为O元素;X的最高正价与最低负价的代数和为0,X、Y同周期,则X为C元素,据此解答.
解答 解:X、Y、W、R是原子序数依次增大的短周期主族元素,W的正二价阳离子与氖原子具有相同的核外电子排布,则W为Mg元素;R原子的最外层电子数是其电子层数的2倍,原子序数大于Mg,处于第三周期,最外层电子数为6,故R为S元素;Y、R同主族,则Y为O元素;X的最高正价与最低负价的代数和为0,X、Y同周期,则X为C元素.
A.H与C元素形成烃类物质,化合物种类繁多,故A正确;
B.W为Mg,R为S,二者同周期,原子序数依次增大,原子半径依次减小,故B错误;
B.非金属性O>S,故氢化物稳定性H2O>H2S,故C错误;
D.X、R的最高价氧化物的水化物分别为碳酸、硫酸,碳酸是弱酸,而硫酸是强酸,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
9.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 甲烷与氯气发生取代反应 | |
| B. | 丙烯与水在催化剂的作用下发生加成反应 | |
| C. | 异戊二烯[CH2═C(CH3)-CH═CH2]与等物质的量的Br2发生加成反应 | |
| D. | 2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热 |
7.下列变化过程属于物理变化的是( )
| A. | 海水提溴 | B. | 石油分馏 | C. | 油脂硬化 | D. | 蔗糖水解 |
14.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 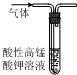 除去CO2中混有的SO2 | B. | 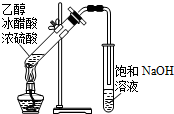 制取较纯净的乙酸乙酯 | ||
| C. | 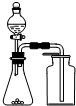 用生石灰和浓氨水制取氨气 | D. | 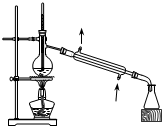 分离苯和四氯化碳的混合物 |
8.下列关系正确的是( )
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CHCl3>H2O>己烷 | |
| C. | 氢元素质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 等质量物质完全燃烧耗O2量:苯>环已烷>已烷 |

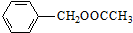 是其中的一种,该有机物能发生的反应为a(填字母).
是其中的一种,该有机物能发生的反应为a(填字母).