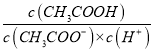题目内容
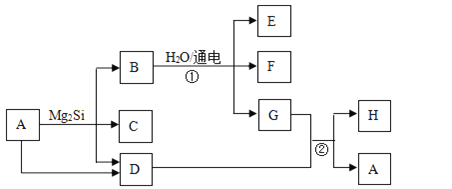
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷.为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示). 
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊.
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b.
(1)碳化铝与稀硫酸反应的化学方程式为 .
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 , (实验测得消耗甲烷与氧化铜物质的量之比2:7)
(3)实验甲中浓硫酸的作用是 , 集气瓶中收集到的气体(填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 . 除了上述现象外,该实验中还可能观察到的现象有(填序号).
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同.
【答案】
(1)Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑
(2)2CH4+7CuO ![]() 7Cu+CO2+CO+4H2O
7Cu+CO2+CO+4H2O
(3)干燥甲烷;不能
(4)A
(5)CH4+Cl2 ![]() CH3Cl+HCl;ABC
CH3Cl+HCl;ABC
【解析】解:(1)碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷,碳化铝与硫酸反应可理解为碳化铝(Al4C3)与水反应,产物再和硫酸反应,所以产物为硫酸铝和甲烷,反应方程式为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,所以答案是:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑;(2)甲烷中碳元素化合价为﹣4价,甲烷与氧化铜反应,碳元素化合价升高,甲烷与氧化铜物质的量之比2:7,先根据氢守恒确定水前系数,再根据碳、氧守恒得硬质试管里可能发生的化学方程式为:2CH4+7CuO ![]() 7Cu+CO+CO2+4H2O,
7Cu+CO+CO2+4H2O,
所以答案是:2CH4+7CuO ![]() 7Cu+CO+CO2+4H2O;(3)碳化铝与硫酸反应生成硫酸铝和甲烷,甲方案探究甲烷与氧化剂反应,盛放浓硫酸的装置放置在氧化剂氧化铜之前,所以实验甲中浓硫酸的作用是干燥CH4 , 甲烷和氧化铜反应,碳元素化合价升高,生成碳的氧化物,产物中可能有一氧化碳生成,所以集气瓶中收集到的气体不能直接排放到空气中,
7Cu+CO+CO2+4H2O;(3)碳化铝与硫酸反应生成硫酸铝和甲烷,甲方案探究甲烷与氧化剂反应,盛放浓硫酸的装置放置在氧化剂氧化铜之前,所以实验甲中浓硫酸的作用是干燥CH4 , 甲烷和氧化铜反应,碳元素化合价升高,生成碳的氧化物,产物中可能有一氧化碳生成,所以集气瓶中收集到的气体不能直接排放到空气中,
所以答案是:干燥甲烷;不能;(4)A.甲烷不能与强氧化剂反应,若能反应,则酸性高锰酸钾溶液在甲烷的作用下会褪色,现不褪色,结论是通常条件下,甲烷不能与强氧化剂反应,故A正确;
B.硬质试管里黑色粉末变红色,可能为铜,即黑色的氧化铜被还原为铜单质,氧化铜中铜元素化合价降低,表现氧化性,发生还原反应,故B错误;
C.氧化铜与甲烷反应生成水和二氧化碳、一氧化碳,硬质试管里黑色粉末也能变红色,故C错误;
D.甲烷不能与溴水反应,但甲烷能与卤素单质发生取代反应,故D错误;
故选A;(5)乙方案中烧杯里放入足量的水,甲烷和氯气在光照条件下发生取代反应,CH4+Cl2 ![]() CH3Cl+HCl,CH3Cl+Cl2
CH3Cl+HCl,CH3Cl+Cl2 ![]() CH2Cl2+HCl,CH2Cl2+Cl2
CH2Cl2+HCl,CH2Cl2+Cl2 ![]() CHCl3+HCl,CHCl3+Cl2
CHCl3+HCl,CHCl3+Cl2 ![]() CCl4+HCl,生成物中CH3Cl(气体)、CH2Cl2(油状液体)、CHCl3(油状液体)、CCl4(油状液体)、HCl(极易溶于水),打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但CH3Cl(气体)难溶于水,所以水并不能充满I瓶,氯气为黄绿色气体、反应后I瓶中气体颜色变浅,HCl(极易溶于水),I瓶中出现白雾,CH2Cl2(油状液体)、CHCl3(油状液体)、CCl4(油状液体)、I瓶瓶内壁出现油状物质,Ⅱ瓶中无现象,II瓶中与I瓶现象不相同,所以ABC符合.
CCl4+HCl,生成物中CH3Cl(气体)、CH2Cl2(油状液体)、CHCl3(油状液体)、CCl4(油状液体)、HCl(极易溶于水),打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但CH3Cl(气体)难溶于水,所以水并不能充满I瓶,氯气为黄绿色气体、反应后I瓶中气体颜色变浅,HCl(极易溶于水),I瓶中出现白雾,CH2Cl2(油状液体)、CHCl3(油状液体)、CCl4(油状液体)、I瓶瓶内壁出现油状物质,Ⅱ瓶中无现象,II瓶中与I瓶现象不相同,所以ABC符合.
所以答案是:CH4+Cl2 ![]() CH3Cl+HCl;ABC.
CH3Cl+HCl;ABC.

 阅读快车系列答案
阅读快车系列答案