题目内容
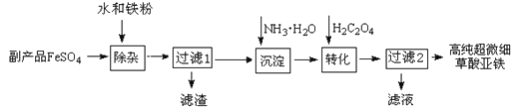
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3
②5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2↑+2Mn2+ +8H2O
(1)除杂过程中加入Fe的作用是___________________________。
(2)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2mol·L-1 的H2SO4溶解。
步骤2:用c mol·L-1标准KMnO4溶液滴定,消耗其体积a mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液b mL。
① KMnO4溶液应该装在_______________滴定管中。
② 用KMnO4溶液滴定待测液,达到滴定终点的标志是__________________________________。
③ 下列操作会导致测定结果中样品的C2O42- 的物质的量偏大的是____________________
A. 步骤2中,滴定管未用标准KMnO4 溶液润洗
B. 步骤3中加入Zn不足
C. 步骤2中,读标准溶液体积时,先仰视后俯视
D. 步骤4中,读标准溶液体积时,先俯视后仰视
④ 样品中C2O42- 的物质的量为_______________________。
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+ 的浓度随反应时间t的变化如下图,其变化趋势的原因可能为__________________________________。

【答案】 防止Fe2+ 被氧化 防止NH3·H2O和Fe(OH)2受热分解 酸式 滴入最后一滴KMnO4溶液,溶液突然变成紫红色,且半分钟内不再恢复为原来的颜色 AB 2.5c(a-b)×10-3mol 生成的Mn2+ 作起催化作用,随着Mn2+ 浓度增加,反应速率越来越快
【解析】副产品FeSO4(含TiO2+、Al3+)中加入铁粉,将少量杂质离子除去,同时防止Fe2+ 被氧化,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀。
(1)由于Fe2+被具有很强的还原性,容易被氧化为Fe3+,铁粉的还原性比Fe2+强,因此可以防止Fe2+被氧化,另外Fe能与H+反应生成Fe2+,降低了氢离子的浓度,调节pH值,使Al3+水解完全生成Al(OH)3沉淀,故答案为:防止Fe2+ 被氧化等;
(2)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;故答案为:NH3H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解;
(3)① KMnO4溶液具有强氧化性,应该装在酸式滴定管中,故答案为:酸式;
② 用KMnO4溶液滴定待测液,终点时滴入最后一滴KMnO4溶液,溶液突然变成紫红色,且半分钟内不再恢复为原来的颜色,故答案为:滴入最后一滴KMnO4溶液,溶液突然变成紫红色,且半分钟内不再恢复为原来的颜色;
③A. 步骤2中,滴定管未用标准KMnO4 溶液润洗,导致消耗的标准KMnO4 溶液的体积偏大,则样品的C2O42- 的物质的量偏大,正确;B. 步骤3中加入Zn不足,导致铁离子未完全还原,使得测得的亚铁离子的含量偏少,样品的C2O42- 的物质的量偏大,正确;C. 步骤2中,读标准溶液体积时,先仰视后俯视,导致消耗的标准KMnO4 溶液的体积偏小,则样品的C2O42- 的物质的量偏低,错误;D. 步骤4中,读标准溶液体积时,先俯视后仰视,导致步骤4中消耗的标准KMnO4 溶液的体积偏大,使得测得的亚铁离子的含量偏多,样品的C2O42- 的物质的量偏小,错误;故选AB;
④由题意知步骤2氧化C2O42-和Fe2+共消耗c molL-1标准KMnO4溶液体积a mL,步骤3、4标准KMnO4溶液只氧化Fe2+,消耗KMnO4溶液体积bmL,所以C2O42-消耗KMnO4溶液体积为(a-b)mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以n(C2O42-)=![]() n(MnO4-)=(a-b)×10-3L×cmolL-1×
n(MnO4-)=(a-b)×10-3L×cmolL-1×![]() =2.5c(a-b)×10-3mol;故答案为: 2.5c(a-b)×10-3mol;
=2.5c(a-b)×10-3mol;故答案为: 2.5c(a-b)×10-3mol;
(4)从图像上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。

【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
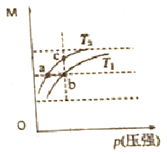
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。