题目内容
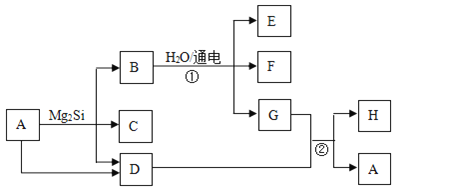
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝;G呈绿色,H在空气中含量最高;C的摩尔质量为32g/mol;E为难溶性碱。
(1)C的化学式为_________。
(2)H的电子式为_________。
(3)写出反应①的离子方程式: _________。
(4)写出反应②的化学方程式: _________。
【答案】 SiH4 ![]() Mg2++2Cl-+2H2O
Mg2++2Cl-+2H2O![]() Mg(OH)2+H2+Cl2 8NH3+3Cl2=N2+6NH4Cl
Mg(OH)2+H2+Cl2 8NH3+3Cl2=N2+6NH4Cl
【解析】根据题意分析D、F、G、H均为常见气体,D能使湿润的红色石蕊变蓝,说明D是NH3;G为绿色,说明G是氯气;H在空气中含量最高,说明H是N2,C的摩尔质量为32g/mol,由转化关系可以知道应含有Si元素,则C为SiH4,B应为MgCl2,则E为Mg(OH)2,F为H2,A为NH4Cl;
(1)C的化学式为SiH4;
(2)H的电子式为![]() ;
;
(3)反应①为氯化镁溶液的电解,离子方程式为Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
(4)反应②为氯气和氨气的反应,化学方程式,8NH3+3Cl2=N2+6NH4Cl。

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).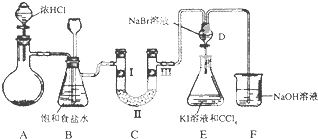
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .