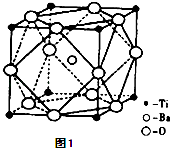
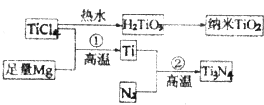
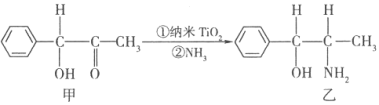
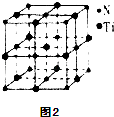
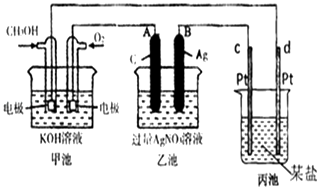
题目内容
【题目】在室温下,下列关于pH=3的CH3COOH溶液和pH=3的HCl溶液的叙述中不正确的是
A. 两种溶液中溶质的物质的量浓度:CH3COOH>HCl
B. 向CH3COOH溶液中通入HCl(g), 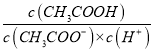 的值不变
的值不变
C. 均与pH=11的氨水混合,使溶液显中性,两溶液的导电性相同,水的电离程度也相同
D. 在CH3COONa溶液中分别加入等量的上述两种溶液,溶液中的c(Na+)/c(CH3COO-)前者减小,后者增加
【答案】C
【解析】A. pH=3的HCl溶液,盐酸浓度为0.001molL-1,醋酸为弱酸,pH=3的CH3COOH溶液,醋酸浓度大于0.001molL-1,故A正确;B.醋酸电离平衡醋酸Ka=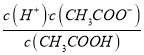 ,HCl电离出氢离子而抑制醋酸电离,c(CH3COO)降低、c(CH3COOH)增大,电离平衡常数只与温度有关,温度不变,电离平衡常数不变,则
,HCl电离出氢离子而抑制醋酸电离,c(CH3COO)降低、c(CH3COOH)增大,电离平衡常数只与温度有关,温度不变,电离平衡常数不变,则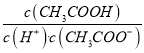 不变,故B正确;C. 均与pH=11的氨水混合,溶液中分别生成氯化铵、醋酸铵,溶液显中性,两溶液中c(NH4+)=c(Cl-)、c(NH4+)=c(CH3COO-),且c(H+)=c(OH-),因此溶液的导电性相同,但盐酸反应后溶液中含有氨水,抑制了水的电离,醋酸铵溶液中促进了水的电离,水的电离程度不同,故C错误;D. 在CH3COONa溶液中加入pH=3的CH3COOH溶液,抑制水解,c(Na+)/c(CH3COO-)减小,加入pH=3的HCl溶液,促进水解,c(Na+)/c(CH3COO-)增大,故D正确;故选C。
不变,故B正确;C. 均与pH=11的氨水混合,溶液中分别生成氯化铵、醋酸铵,溶液显中性,两溶液中c(NH4+)=c(Cl-)、c(NH4+)=c(CH3COO-),且c(H+)=c(OH-),因此溶液的导电性相同,但盐酸反应后溶液中含有氨水,抑制了水的电离,醋酸铵溶液中促进了水的电离,水的电离程度不同,故C错误;D. 在CH3COONa溶液中加入pH=3的CH3COOH溶液,抑制水解,c(Na+)/c(CH3COO-)减小,加入pH=3的HCl溶液,促进水解,c(Na+)/c(CH3COO-)增大,故D正确;故选C。

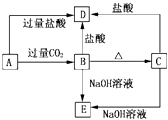
【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).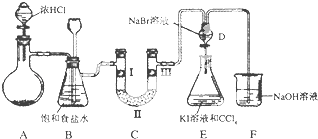
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .
【题目】下列实验能达到相应实验目的的是
选项 | 实验内容 | 实验目的 |
A | 在5mL 0.005mol/L FeCl3和5mL 0.1mol/L KSCN的混合溶液中,加入饱和FeCl3溶液,溶液的红色加深 | 验证浓度对化学平衡的影响 |
B | 室温下,用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 常温下,测得浓度均为0.1mol/L溶液的pH:NaA>NaB | 证明常温下的Ka:HA<HB |
D | 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是强酸 |
A. A B. B C. C D. D