题目内容
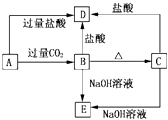
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①相同温度下,同浓度的5中溶液中,水的电离程度的大小顺序为:E=B>C>A=D
②B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
③浓度均为0.1mol·L-1 C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是___________,E是___________;
(2)用水稀释0.1mol·L-1 B溶液时,溶液中随着水量的增加而减小的是_________(填写序号)
a. ![]() b.
b. ![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是_____________(填写序号)。
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E d.E溶液里有镁粉剩余
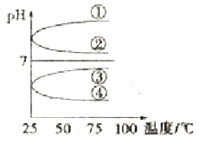
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中________曲线(填写序号)。
【答案】 NaOH CH3COOH a c ④
【解析】(1)五种物质中NaOH、NH3H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,前两种五种与后三种物质等物质的量反应,但生成物一种酸性,一种中性的,只有与HCl反应,NaCl溶液显中性,NH4Cl显酸性,则A为HCl、B为NH 3H2O、D为NaOH;浓度均为0.1molL-1C与D溶液等体积混合,溶液呈酸性,所以C为NH4HSO4,则E为CH3COOH,故答案为:NaOH;CH3COOH;
(2)用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH-)增大,溶液体积不变,浓度之比等于物质的量之比, 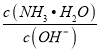 减小,a正确、d错误;温度不变,水的离子积常数不变,由Kw=c(H+)c(OH-)知c(H+)c(OH-)不变,b错误;稀释时c(OH-)减小,由kw=c(H+)c(OH-)不变知c(H+)增大.故答案为:a
减小,a正确、d错误;温度不变,水的离子积常数不变,由Kw=c(H+)c(OH-)知c(H+)c(OH-)不变,b错误;稀释时c(OH-)减小,由kw=c(H+)c(OH-)不变知c(H+)增大.故答案为:a
(3)pH相同的等体积的两份溶液HCl和CH3COOH,开始时c(H+)相同,反应速率相同,B错误;反应开始后,醋酸继续电离,c(H+)增大,反应速率大,反应生成等量氢气时所用时间少,A错误;pH相同等体积则CH3COOH的浓度大,物质的量多,完全反应消耗的锌粉多,所用醋酸中不可能剩余锌粉,d错误;生成等量的氢气,根据方程式知消耗的锌粉相同,c正确;故答案为:c;
(4)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,pH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,pH减小,③错误、④正确,故答案为:④。