题目内容
16.常温下,0.01mol•L-1 NaHY(酸式盐,Y表示原子或原子团)溶液,下列说法正确的是( )| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
分析 若NaHY为强酸的酸式盐,则溶液显酸性,在溶液中完全电离;
若NaHY为弱酸的酸式盐,在溶液中存在电离平衡和水解平衡,结合水解平衡和电离平衡程度的相对大小分析.
解答 解:A.若NaHY为弱酸的酸式盐,而且在溶液中水解平衡程度大于电离平衡程度,则溶液显碱性,故A错误;
B.若NaHY为强酸的酸式盐,则溶液显酸性,在溶液中完全电离,Y2-不水解,不存在Y2-+H2O?OH-+HY-,故B错误;
C.若显酸性,溶液加水稀释,酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,若显碱性,加水稀释,氢氧根离子浓度减小,氢离子浓度增大,故C错误;
D.若NaHY为强酸的酸式盐,则c(Na+)=c(Y2-),若为弱酸的酸式盐,则c(Na+)>c(Y2-),所以溶液中:c(Na+)≥c(Y2-),故D正确.
故选D.
点评 本题考查了弱电解质的电离和盐的水解,该题分两种情况强酸的酸式盐和弱酸的酸式盐分析,侧重于学生的分析能力的考查,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
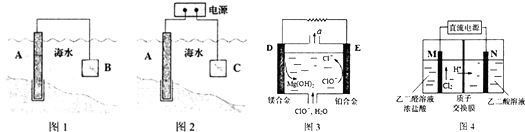
4.如图1为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: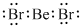 .
.
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为平面正三角形,eg3、e2g6中心原子e的杂化方式分别为sp2、sp3.
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:Cu+4HCl=H2CuCl4+H2↑.
(4)f、g、h、i四种元素对应单质分子的键能如下表:
试从原子半径角度阐述f-f键键能反常的原因:F原子半径较小,价电子较多,导致电子云密度增大,极大增加了两原子间的排斥作用,故键能较小,共价键易断裂.
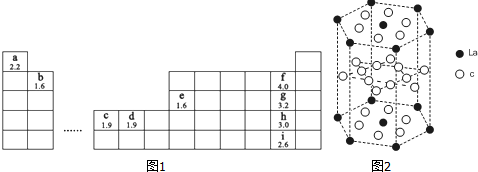
(5)c元素的元素符号是Ni,价电子排布式为3d84s2,下图是一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图2中勾画出该晶体的一个晶胞.计算出该合金的化学式为:LaNi5.

(1)b、h两元素可形成化合物bh2,写出其电子式:
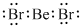 .
.(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为平面正三角形,eg3、e2g6中心原子e的杂化方式分别为sp2、sp3.
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:Cu+4HCl=H2CuCl4+H2↑.
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
(5)c元素的元素符号是Ni,价电子排布式为3d84s2,下图是一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图2中勾画出该晶体的一个晶胞.计算出该合金的化学式为:LaNi5.
11.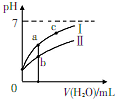 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 向NaCl0溶液中通人少量二氧化碳的离子方程式为:2C1O-+CO2+H2O=2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | a、b、c三点所示溶液中水的电离程度:c>a>b | |
| D. | 图象中,I表示CH3COOH,Ⅱ表示HC1O,且溶液导电性:c>b>a |
1.下列物质的性质与应用对应关系正确的是( )
| A. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 | |
| B. | Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | Na、K合金具有强还原性,可用于原子反应堆的导热剂 |
8.化学来源于生活,服务于生活,下列有关叙述正确的是( )
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 冰箱中使用的含氟制冷剂泄漏后,会增加空气中PM 2.5的含量 | |
| C. | 氯气和活性炭均可作为漂白剂,同时使用可增强漂白效果 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
5.硼和铝是同主族元素,在生产、生活和科研中具有广泛的应用.以下是几种常见的硼化合物:
请回答下列问题:
(1)写出硼元素在周期表中的位置第二周期ⅢA族.
(2)工业上以硼镁矿为原料制取硼,该工艺的中间过程会发生反应:B2O3+3Mg=2B+3MgO,则每生成1mol的硼转移的电子数为3NA.
(3)工业上常用金属铝冶炼难熔金属,请写出以五氧化二矾(V2O5)和铝为原料获得金属矾的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(4)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,请写出硼酸与氢氧化钠反应的离子方程式H3BO3+OH-=[B(OH)4]-.
(5)硼氢化钠(NaBH4)是一种强还原剂,遇水剧烈反应产生大量气体,请写出该反应的化学方程式NaBH4+2H2O═NaBO2+4H2↑.
(6)偏硼酸钠能溶于水,其溶液显碱性(填“酸性”、“中性”或“碱性”),原因是BO2-+2H2O?H3BO3+OH-(用离子方程式表示)
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
(1)写出硼元素在周期表中的位置第二周期ⅢA族.
(2)工业上以硼镁矿为原料制取硼,该工艺的中间过程会发生反应:B2O3+3Mg=2B+3MgO,则每生成1mol的硼转移的电子数为3NA.
(3)工业上常用金属铝冶炼难熔金属,请写出以五氧化二矾(V2O5)和铝为原料获得金属矾的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(4)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,请写出硼酸与氢氧化钠反应的离子方程式H3BO3+OH-=[B(OH)4]-.
(5)硼氢化钠(NaBH4)是一种强还原剂,遇水剧烈反应产生大量气体,请写出该反应的化学方程式NaBH4+2H2O═NaBO2+4H2↑.
(6)偏硼酸钠能溶于水,其溶液显碱性(填“酸性”、“中性”或“碱性”),原因是BO2-+2H2O?H3BO3+OH-(用离子方程式表示)
6.下列物质属于纯净物的是( )
| A. | 冰水 | B. | 海水 | C. | 盐水 | D. | 雨水 |