题目内容
【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
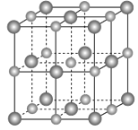
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
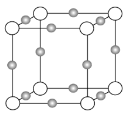
【答案】分子晶体 原子晶体 金属晶体 离子晶体 TiN>MgO>CaO>KCl 铜 3d10 6 正八面体
【解析】
(1)根据各类晶体性质变化规律分析判断晶体类型;
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,据此判断四种物质熔点高低;
(3) K、L、M三个电子层全充满的X+中原子序数=核内质子数=电子数+电荷数,据此确定该元素,根据原子核外电子排布规律书写该离子的价电子排布式;采用X、Y、Z三轴切割的方法确定X+个数,根据Cu+在N3-周围的相对位置确定其构成的空间构型。
(1) A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2,说明晶体A属于分子晶体;
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃,则晶体B为原子晶体;
C.固态和熔融态时都能导电,能溶于盐酸,则晶体C为金属晶体;
D.固态时不导电,液态时能导电,可溶于水,证明晶体D为离子晶体;
(2)离子晶体的晶格能越大,其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,N3-电荷大于Mg2+和Ca2+,Mg2+和Ca2+电荷大于K+,Mg2+和半径小于Ca2+半径,所以4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl;
(3)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则该原子含有29个电子,元素X为铜元素,Cu原子核外电子排布是1s22s22p63s23p63d104s1,故X+的价电子排布式为3d10;采用X、Y、Z三轴切割的方法知X+个数是6;这六个Cu+构成的是正八面体结构。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
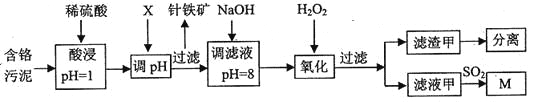
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 6.7 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 9.3 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________(任写一条)。
(2)调节pH所用X可以选用______。
A.NaOH B.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为________。
(4)调滤液至pH=8,则滤液中______将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=______。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)
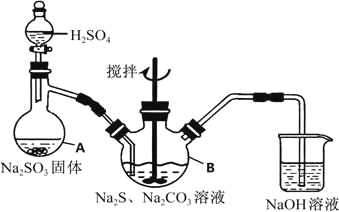
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 常温下,用pH 计分测 | pH | 酸性: |
B | 向 | 溶液褪色 | 乙二酸具有还原性 |
C |
| 先有白色沉淀,后沉淀消失 |
|
D | 取2mL | 先有白色沉淀生成;后有红褐色沉淀生成 |
|
A.AB.BC.CD.D