题目内容
【题目】皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
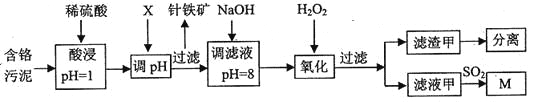
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 6.7 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 9.3 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________(任写一条)。
(2)调节pH所用X可以选用______。
A.NaOH B.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为________。
(4)调滤液至pH=8,则滤液中______将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=______。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)
【答案】升温或搅拌或多次浸取或适当延长酸浸时间或适当提高酸的浓度等 A B 3:2 Al3+、Cu2+ 2.2×108-2amol·L-1
【解析】
含铬污泥酸浸后调节溶液PH,过滤得到固体针铁矿,和滤液,加入氢氧化钠溶液调节溶液pH=8,Al3+、Cu2+转化为沉淀除去,得到滤液加入过氧化氢氧化铬离子为重铬酸根离子,过量得到滤液中通入二氧化硫还原生成M;
(1)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(2)调节溶液pH不能引入新的杂质;
(3)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,加入NaOH溶液使溶液呈碱性,调滤液至pH=8,Al3+、Cu2+、Mg2+中,Al3+、Cu2+离子全部沉淀;
(5)若滤液甲的pH=a,结合离子积常数计算溶液中氢氧根离子浓度,利用沉淀溶解平衡的溶度积常数计算溶液中c (Cu2+)浓度。
(1)酸浸时,提高浸取效率也即通过反应的速率,所以可采取的措施升温或搅拌或多次浸取或适当延长酸浸时间或适当提高酸的浓度等;
(2)调节溶液的pH目的是使Fe3+沉淀,所以加入的试剂是与硫酸反应的物质,氢氧化钠、碳酸钠均与硫酸反应,降低溶液的酸性,而硫酸或硝酸只能使溶液的酸性增强,所以答案选AB;
(3)加入H2O2目的,是把Cr(OH)3沉淀转化为Cr2072-,而本身被还原为水,所以该转化过程中,消耗的H2O2与Cr(OH)3的物质的量之比即为O元素、Cr元素得、失电子数目的反比,O元素共得到2个电子,Cr元素失去3个电子,所以比值为3:2;
(4)加入氢氧化钠溶液调节溶液的pH=8,目的是使Al3+、Cu2+沉淀,因为镁离子完全沉淀的pH是9.3>8,所以pH=8时不能将镁离子完全转化为沉淀,而Al3+、Cu2+完全沉淀的pH小于或等于8,所以调滤液至pH=8,则使滤液中Al3+、Cu2+沉淀;
(5)因为铜离子完全沉淀后,得到的滤液甲为氢氧化铜的饱和溶液,若溶液甲的pH=a,则氢氧根离子的浓度是10a-14mol/L,根据Ksp[Cu(OH)2]=2.2×10-20=c(OH-)2c(Cu2+),所以c(Cu2+)=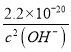 =2.2×108-2a mol/L。
=2.2×108-2a mol/L。

【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
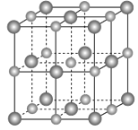
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
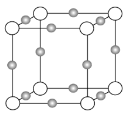
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
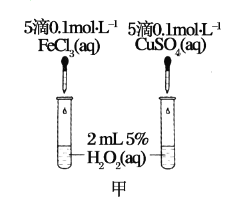
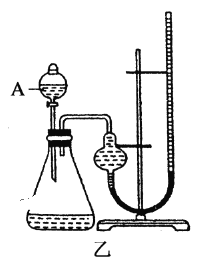
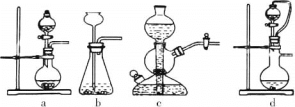
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D