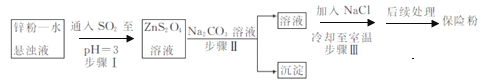
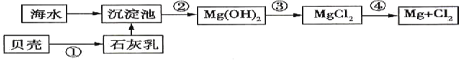题目内容
【题目】含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:![]()
![]() 在含
在含![]() 价铬的废水中加入一定量的硫酸和硫酸亚铁,使
价铬的废水中加入一定量的硫酸和硫酸亚铁,使![]() 价铬还原成
价铬还原成![]() 价铬;再调节溶液pH在
价铬;再调节溶液pH在![]() 之间,使
之间,使![]() 和
和![]() 转化为
转化为![]() 、
、![]() 沉淀而除去.
沉淀而除去.
![]() 写出
写出![]() 与
与![]() 溶液在酸性条件下反应的离子方程式 ______ .
溶液在酸性条件下反应的离子方程式 ______ .
![]() 用离子方程式表示溶液pH不能超过10的原因 ______ .
用离子方程式表示溶液pH不能超过10的原因 ______ .
![]() 将含
将含![]() 价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的
价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的![]() 和
和![]() 发生反应,生成的
发生反应,生成的![]() 和
和![]() 在阴极区与
在阴极区与![]() 结合成氢氧化物沉淀而除去.
结合成氢氧化物沉淀而除去.
![]() 写出阴极的电极反应式 ______ .
写出阴极的电极反应式 ______ .
![]() 电解法中加入氯化钠的作用是 ______ .
电解法中加入氯化钠的作用是 ______ .
![]() 某化学兴趣小组以含
某化学兴趣小组以含![]() 价铬和
价铬和![]() 价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
![]() 取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
![]() 取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水
取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水![]() ______ 时,锰、铬去除率最好.
______ 时,锰、铬去除率最好.

【答案】![]()
![]()
![]() 或
或![]() 增强溶液导电性
增强溶液导电性 ![]() 4
4
【解析】
(1)①二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
②由题意可知,当pH超过10即c(OH-)≥10-4mol![]() L-1时,Cr(OH)3转变成CrO2-,
L-1时,Cr(OH)3转变成CrO2-,
(2)①阴极上水中的氢离子放电生成氢气;
②水是弱电解质,导电性能较差,氯化钠是强电解质能增强水的导电性;
(3)根据图可知,当两种离子的去除率都较大时所对应的pH值和百分量即可。
![]() 二价铁离子有还原性,
二价铁离子有还原性,![]() 有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,
有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,![]() 被还原为
被还原为![]() ,反应方程式为:
,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由题意可知,当pH超过10即
由题意可知,当pH超过10即![]() 时,
时,![]() 转变成
转变成![]() ,发生
,发生![]() ,故答案为:
,故答案为:![]() ;
;
![]() 将含
将含![]() 价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为:
价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为:![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
![]() 水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,故答案为:增强溶液导电性;
水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,故答案为:增强溶液导电性;
![]() 根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为
根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为![]() 时,锰、铬去除率最好;故答案为:
时,锰、铬去除率最好;故答案为:![]() ;
;
![]() 根据图2知,当溶液的pH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当
根据图2知,当溶液的pH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当![]() 时,锰、铬去除率最好;故答案为:4。
时,锰、铬去除率最好;故答案为:4。

【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
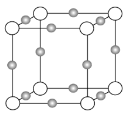
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
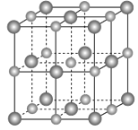
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。