题目内容
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 常温下,用pH 计分测 | pH | 酸性: |
B | 向 | 溶液褪色 | 乙二酸具有还原性 |
C |
| 先有白色沉淀,后沉淀消失 |
|
D | 取2mL | 先有白色沉淀生成;后有红褐色沉淀生成 |
|
A.AB.BC.CD.D
【答案】B
【解析】
![]() 溶液的pH大,可知阴离子的水解程度大,则对应
溶液的pH大,可知阴离子的水解程度大,则对应![]() 的酸性弱,即酸性为
的酸性弱,即酸性为![]() ,选项A错误;
,选项A错误;
B.![]() 酸性溶液中滴加乙二酸,发生氧化还原反应,溶液褪色,可知乙二酸具有还原性,选项B正确;
酸性溶液中滴加乙二酸,发生氧化还原反应,溶液褪色,可知乙二酸具有还原性,选项B正确;
C.![]() 溶液中逐滴加入过量稀氨水,反应生成氢氧化铝,观察到白色沉淀,氢氧化铝不能溶于弱碱,选项C错误;
溶液中逐滴加入过量稀氨水,反应生成氢氧化铝,观察到白色沉淀,氢氧化铝不能溶于弱碱,选项C错误;
D.NaOH过量,均为沉淀的生成,不能比较![]() 、
、![]() 的大小,选项D错误;
的大小,选项D错误;
答案选B。

【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
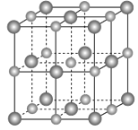
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
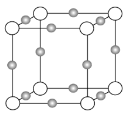
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。
【题目】25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是 ( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同