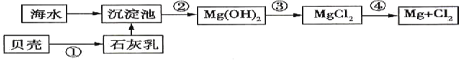题目内容
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如图:
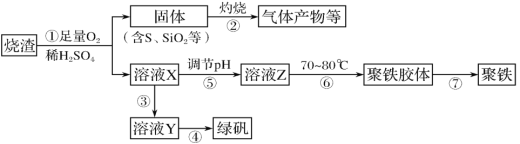
(1)将过程②中产生的气体通入下列溶液中,溶液不褪色的是__(填选项序号)。
A.酸性KMnO4溶液 B.品红溶液 C.紫色石蕊溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为__。
(3)过程③中,需加入的物质是__,反应的离子方程式为__。
(4)用溶液Y制绿矾时,检验溶液Y中是否含有Fe3+的操作是__。
(5)在实验室里,完成过程④中的操作名称是__。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:
①用分析天平称取2.240g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥、称量,得固体质量为2.330g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为__。(假设杂质中不含铁元素和硫元素)
【答案】C 4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S Fe(或铁) 2Fe3++Fe=3Fe2+ 取少量的溶液Y于试管中,滴加硫氰化钾溶液,若溶液变红,则含有Fe3+,若溶液不变红,则不含有Fe3+ 蒸发浓缩、冷却结晶 25.0%
【解析】
煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)中通入足量O2,并加入稀硫酸,铁的氧化物溶于稀硫酸生成硫酸铁和水,FeS、O2、H2SO4反应生成Fe2(SO4)3、S和水;所得固体(含S、SiO2)灼烧,S与O2反应生成SO2;溶液X为Fe2(SO4)3溶液,加入Fe,可将Fe3+还原为Fe2+,从而获得绿矾;调节溶液X的pH,Fe3+发生水解生成聚铁胶体。
(1)将过程②中产生的气体为SO2,具有较强的还原性和漂白性,能将酸性KMnO4溶液、溴水还原,能使品红褪色,但只能使紫色石蕊溶液变红色,故选C。答案为:C;
(2)过程①中,FeS和O2、H2SO4发生氧化还原反应,生成Fe2(SO4)3、S和水,化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S。答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)过程③中,需加入还原剂,将Fe3+还原为Fe2+,同时不引入新的杂质,所以该物质是Fe(或铁),反应的离子方程式为2Fe3++Fe=3Fe2+。答案为:Fe(或铁);2Fe3++Fe=3Fe2+;
(4)用溶液Y[Fe2(SO4)3]制绿矾时,检验溶液Y中是否含有Fe3+,常使用KSCN溶液,其操作是取少量的溶液Y于试管中,滴加硫氰化钾溶液,若溶液变红,则含有Fe3+,若溶液不变红,则不含有Fe3+。答案为:取少量的溶液Y于试管中,滴加硫氰化钾溶液,若溶液变红,则含有Fe3+,若溶液不变红,则不含有Fe3+;
(5)过程④为从FeSO4溶液中获得绿矾,应采用蒸发浓缩、冷却结晶的方法,所以完成过程④中的操作名称是蒸发浓缩、冷却结晶。答案为:蒸发浓缩、冷却结晶;
(6)m(BaSO4)=2.330g,聚铁的主要成分为[Fe(OH)SO4]n,n(Fe3+)= n(![]() )=
)=![]() =0.01mol,则聚铁样品中铁元素的质量分数为
=0.01mol,则聚铁样品中铁元素的质量分数为![]() =25.0%。答案为:25.0%。
=25.0%。答案为:25.0%。

【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。