题目内容
10.用惰性电极电解硫酸铜溶液,一段时间后停止通电,向烧杯中加入9.8g氢氧化铜固体,恰好使溶液恢复到电解前组成,那么在电解过程中,转移电子数为( )| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电,说明电解过程中电解的是硫酸铜和水后,继续电解部分水,依据电子守恒计算电子转移.
解答 解:Cu(OH)2从组成上可看成CuO•H2O,加入9.8g即$\frac{9.8}{98}$=0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,电解0.1mol硫酸铜溶液电解完成后,又电解了0.1mol H2O,由电解的总反应式:
2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4mol.
故选:B.
点评 本题考查电解池的工作原理,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.在生活、生产中为增大化学反应速率而采取的措施合理的是( )
| A. | 食物放在冰箱里 | B. | 在糕点包装内放置小包除氧剂 | ||
| C. | 燃煤发电时用煤粉代替煤块 | D. | 塑料制品中添加抑制剂 |
1.下列图示与对应的叙述相符的是( )
| A. | 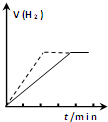 向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,如图虚线表示加入CuSO4溶液时氢气体积与时间的关系 | |
| B. | 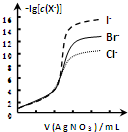 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图曲线,可确定首先沉淀的是Cl- | |
| C. | 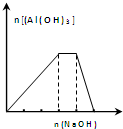 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 | |
| D. | 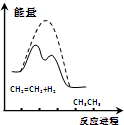 由图可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
5.下列说法不正确的是( )
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂 和蛋白质都是高分子化合物 | |
| C. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| D. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
15.要从KClO3、MnO2制O2后的混合物中提取出KCl,需进行的操作有( )
| A. | 蒸发 | B. | 蒸馏 | C. | 萃取 | D. | 过滤 |
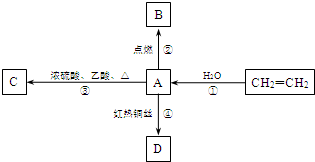 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化. CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.
CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.