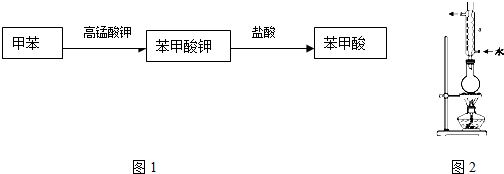
题目内容
7.一种有机镁化合物X可用于制造防毒布料的涂布液,它可吸收空气中的甲醛,其反应原理如图(已配平):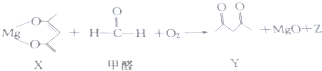
下列有关该反应的说法正确的是( )
| A. | Z的结构式为O-C-O | B. | X是还原剂 | ||
| C. | 甲醛是氧化剂 | D. | 除去1mol甲醛时,转移4mol电子 |
分析 根据质量守恒定律可知,Z的分子式为CO2,结构式为O=C=O;X在反应中得到H,发生还原反应,则X为氧化剂;甲醛在反应中失去H、得到O元素,则甲醛发生氧化反应,在反应中做还原剂;根据方程式可知,出去1mol甲醛消耗了1mol氧气,则反应中转移了4mol电子,据此进行判断.
解答 解:A.根据反应方程式结合质量守恒定律可知,Z的分子式为CO2,结构式为O=C=O,故A错误;
B.X在反应中得到H,发生的是还原反应,则X为氧化剂,故B错误;
C.甲醛在反应中失去H、得到O,故甲醛发生氧化反应,在反应中做的是还原剂,故C错误;
D.根据方程式可知,出去1mol甲醛消耗了1mol氧气,1mol氧气在反应中得到4mol电子,所以反应中除去1mol甲醛时转移了4mol电子,故D正确;
故选D.
点评 本题考查了有机物结构与性质的综合应用,题目难度中等,明确发生反应的实质为解答关键,注意掌握氧化剂、还原剂与氧化反应、还原反应的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
1.已知KNO3在不同温度下的溶解度如下表:下列说法正确的是( )
| 温度/摄氏度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
| A. | 20°C时硝酸钾的溶解度为31.6 | |
| B. | 硝酸钾的溶解度随温度的升高而增大 | |
| C. | 30°C时,100克硝酸钾饱和溶液中含有45.8克硝酸钾 | |
| D. | 40°C的硝酸钾饱和溶液升高温度,溶液中溶质的质量分数增大 |
15.下列实验装置通常不用于物质分离提纯的是( )
| A. | 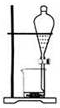 | B. | 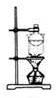 | C. |  | D. |  |
2.将4.4g二氧化碳通入含5.6g氢氧化钠的溶液中,则反应后溶液中的溶质( )
| A. | 只有Na2CO3 | B. | 只有NaHCO3 | ||
| C. | 有Na2CO3也有NaHCO3 | D. | 没有Na2CO3也没有NaHCO3 |
12.将0.46g金属钠投人到足量的水,充分反应中后配制成体积为0.1L的溶液,所得溶液中溶质的物质的量浓度( )
| A. | 等于0.1mol/L | B. | 等于0.2mol/L | C. | 等于0.8mol/L | D. | 等于0.4mol/L |
 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑