题目内容
12.将0.46g金属钠投人到足量的水,充分反应中后配制成体积为0.1L的溶液,所得溶液中溶质的物质的量浓度( )| A. | 等于0.1mol/L | B. | 等于0.2mol/L | C. | 等于0.8mol/L | D. | 等于0.4mol/L |
分析 钠与水发生反应2Na+2H2O=2NaOH+H2↑,根据n=$\frac{m}{M}$金属Na的物质的量,由方程式计算n(NaOH),再根据c=$\frac{n}{V}$计算形成的氢氧化钠溶液的浓度.
解答 解:(1)0.46g金属钠的物质的量为$\frac{0.46g}{23g/mol}$=0.02mol,
令生成的氢氧化钠的物质的量为ymol,则:
2Na+2H2O=2NaOH+H2↑
2 2
0.02mol ymol
所以2:2=0.02mol:ymol,解得y=0.02mol,
故所得氢氧化钠溶液的物质的量浓度为$\frac{0.02mol}{0.1L}$=0.2mol/L,故选B.
点评 本题考查根据方程式的计算、常用化学计量的有关计算等,比较基础,注意基础知识的掌握.

练习册系列答案
相关题目
5.下列用途不属于氮气用途的是( )
| A. | 保鲜蔬菜 | B. | 做保护气 | C. | 做冷冻剂 | D. | 供给呼吸 |
5.许多化学物质都是一柄“双刃剑”,请仿照例子,说出下列物质的功与过.
| 物质的化学式 | 功 | 过 |
| 例:CO2 | 固态CO2(干冰)可用于人工降雨 | 空气中CO2含量过高造成温室效应 |
| O2 | ||
| H2 |
7.一种有机镁化合物X可用于制造防毒布料的涂布液,它可吸收空气中的甲醛,其反应原理如图(已配平):
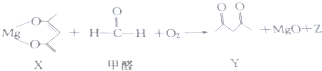
下列有关该反应的说法正确的是( )
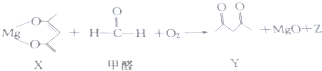
下列有关该反应的说法正确的是( )
| A. | Z的结构式为O-C-O | B. | X是还原剂 | ||
| C. | 甲醛是氧化剂 | D. | 除去1mol甲醛时,转移4mol电子 |
17.浓硫酸与锌在一定条件下反应,若在反应过程中,锌与硫酸的质量比为26:49,则硫酸的还原产物为( )
| A. | SO2 | B. | S | C. | H2S | D. | ZnSO4 |
11.将 4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经 2s(秒)后测得 C 的浓度为 0.6mol•L-1,现有下列正确的是( )
| A. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 2 s 时物质 B 的浓度为 0.7 mol•L-1 | |
| C. | 2 s 时物质 A 的转化率为70% | |
| D. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 |
 Cu(OH)2·CuCl2+2HCl↑+2H2O↑。则下列有关叙述中错误的是( )
Cu(OH)2·CuCl2+2HCl↑+2H2O↑。则下列有关叙述中错误的是( )