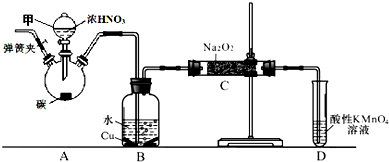
题目内容
2.将4.4g二氧化碳通入含5.6g氢氧化钠的溶液中,则反应后溶液中的溶质( )| A. | 只有Na2CO3 | B. | 只有NaHCO3 | ||
| C. | 有Na2CO3也有NaHCO3 | D. | 没有Na2CO3也没有NaHCO3 |
分析 n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(NaOH)=$\frac{5.6g}{40g/mol}$=0.14mol,二氧化碳和NaOH反应方程式有NaOH+CO2=NaHCO3、2NaOH+CO2=Na2CO3+H2O,如果n(NaOH):n(CO2)≥2时只生成Na2CO3,如果n(NaOH):n(CO2)≤1时只生成NaHCO3,如果介于二者之间则生成碳酸钠和碳酸氢钠,实际上1<n(NaOH):n(CO2)<2,据此判断溶液中溶质成分.
解答 解:n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(NaOH)=$\frac{5.6g}{40g/mol}$=0.14mol,二氧化碳和NaOH反应方程式有 NaOH+CO2=NaHCO3、2NaOH+CO2=Na2CO3+H2O,如果n(NaOH):n(CO2)≥2时只生成Na2CO3,如果n(NaOH):n(CO2)≤1时只生成NaHCO3,如果介于二者之间则生成碳酸钠和碳酸氢钠,实际上1<n(NaOH):n(CO2)<2,则溶液中溶质为Na2CO3、NaHCO3,故选C.
点评 本题考查化学方程式有关计算,为高频考点,明确生成物成分界值是解本题关键,侧重考查学生分析判断及计算能力,题目难度不大.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
15.化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A. | 多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 | |
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 日本福岛核电站爆炸时释放的2种放射性核素13153I和13755Cs的中子数不等 | |
| D. | 食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
16.可以一次性将空气、氧气、氢气、二氧化碳区别开的最好方法是( )
| A. | 分别加入适量澄清石灰水 | B. | 分别滴加紫色石蕊试液 | ||
| C. | 分别将带火星的木条伸入瓶中 | D. | 分别将燃着的木条伸入瓶中 |
7.一种有机镁化合物X可用于制造防毒布料的涂布液,它可吸收空气中的甲醛,其反应原理如图(已配平):
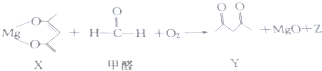
下列有关该反应的说法正确的是( )
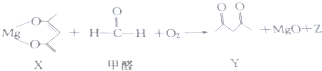
下列有关该反应的说法正确的是( )
| A. | Z的结构式为O-C-O | B. | X是还原剂 | ||
| C. | 甲醛是氧化剂 | D. | 除去1mol甲醛时,转移4mol电子 |