题目内容
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
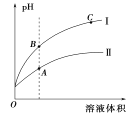
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
【答案】![]() H2CO3>HSO3->HCO3- CH3COOH C 醋酸 ABEF
H2CO3>HSO3->HCO3- CH3COOH C 醋酸 ABEF
【解析】
(1)根据碳酸的第二步电离方程式书写;
(2)在相同条件下,K越大,电离程度越大,电离出的氢离子越多,浓度越大,酸性越强;
(3)①醋酸溶液中存在醋酸分子,稀释时分子电离产生离子,氢离子浓度变化较小;
②加水稀释,氢离子浓度减小,水的电离程度增大;
(4)同c(H+)同体积的的醋酸和盐酸溶液,醋酸含有未电离的分子,则物质的量多,消耗的碱多;
(5)根据电离平衡常数的大小关系判断。
(1)碳酸的第二步电离方程式为HCO3-CO32-+H+,电离平衡常数表达式![]()
![]() ;
;
(2)在相同条件下,K越大,电离程度越大,电离出的氢离子越多,浓度越大,酸性越强,则H2SO3>CH3COOH>H2CO3;
(3)①开始时pH相同,即相同,酸性:CH3COOH>H2CO3,则醋酸的物质的量浓度小于碳酸,稀释相同倍数时,溶液中剩余碳酸分子电离出的氢离子多于醋酸,则碳酸溶液的pH变化较小,II为碳酸,I为醋酸;
②加水稀释,pH减小,溶液中c(H+)减小,对水的电离抑制性减弱,水的电离程度增大,则C点水的电离程度最大;
(4)同c(H+)同体积的的醋酸和盐酸溶液中醋酸中含有未电离的醋酸分子,而盐酸为强酸,全部电离,加入NaOH时,醋酸消耗的NaOH多于盐酸;
(5)A.Ka1(H2SO3)> Ka1(H2CO3),H2SO3、HCO3-可发生反应,符合题意,A正确;
B.Ka2(H2SO3)> Ka2(H2CO3),HSO3-、CO32-可发生反应,符合题意,B正确;
C.Ka2(H2SO3)<Ka1(H2CO3),HSO3-、HCO3-不能发生反应,与题意不符,C错误;
D.Ka2(H2SO3)>Ka2(H2CO3),HCO3-、SO32-不能发生反应,与题意不符,D错误;
E.Ka2(H2SO3)>Ka2(H2CO3),H2SO3、CO32-可发生反应,符合题意,E正确;
F.Ka1(H2SO3)>Ka2(H2SO3),H2SO3、SO32-可发生反应,符合题意,F正确;
G.Ka1(H2SO3)>Ka1(H2CO3),H2CO3、HSO3-不能发生反应,与题意不符,G错误;
答案为ABEF。

 阅读快车系列答案
阅读快车系列答案