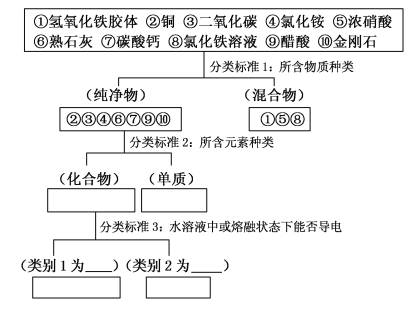
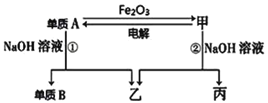
题目内容
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
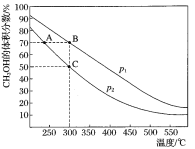
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
【答案】D
【解析】
A.增大压强平衡向正反应方向移动;
B.由图可知,升高温度,平衡逆向移动,该反应的△H<0;
C.平衡常数只与温度有关;
D.设向密闭容器充入了1molCO和2molH2,利用三段法进行数据分析计算.
A.由300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,故A错误;
B.图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,故B错误;
C.A、B处的温度不同,平衡常数与温度有关,故平衡常数不等,故C错误;
D.设向密闭容器充入了1molCO和2molH2,CO的转化率为x,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始 1 2 0
变化 x 2x x
结束 1-x 2-2x x
在C点时,CH3OH的体积分数=x/(1-x+2-2x+x)=0.5,解得x=0.75,故D正确;
故选D。

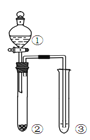
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D