题目内容
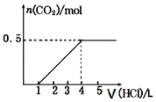
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入0.05 mol·L-1盐酸,得到各成分物质的量变化如图所示(已知1 mol=1000 mmol),下列说法不正确的是( )
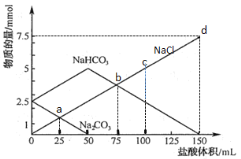
A.a点溶液中Na2CO3与NaCl物质的量相等
B.b点溶液中发生反应的化学方程式为:NaHCO3 + HCl = NaCl+H2O+CO2↑
C.c点溶液中氯化钠的物质的量浓度为0.05 mol·L-1
D.当盐酸加到150 mL时,混合物样品恰好完全反应
【答案】C
【解析】
Na2CO3和HCl的反应分为两步:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;有关量的计算,结合图中的数据去分析计算即可。
A、观察图中信息,Na2CO3的曲线降为0,而NaCl的曲线从0开始,故两条曲线的交点a点表示溶液中Na2CO3与NaCl物质的量相等,A正确;
B、b点时,NaHCO3曲线呈下降的状态,则NaHCO3被消耗,故发生NaHCO3和HCl的反应,B正确;
C、加入50mL盐酸时,Na2CO3的物质的量由2.5mmol降为0,根据反应Na2CO3+HCl=NaHCO3+NaCl 可知50mL盐酸中含有2.5mmol HCl,即c(HCl)=![]() =50mmol·L-1;c点时,NaHCO3和HCl的反应还不完全,则根据氯元素守恒,可得n(NaCl)=n(HCl)100mL=50mmol·L-1×0.1L=5mmol,则n(NaCl)=
=50mmol·L-1;c点时,NaHCO3和HCl的反应还不完全,则根据氯元素守恒,可得n(NaCl)=n(HCl)100mL=50mmol·L-1×0.1L=5mmol,则n(NaCl)=![]() =0.033mol·L-1,C错误;
=0.033mol·L-1,C错误;
D、由图知,开始时,Na2CO3、NaHCO3的物质的量为2.5mmol,完全反应需要7.5mmol HCl,c(HCl)=50mmol·L-1,则V(HCl)=![]() =0.15L=150mL,D正确;
=0.15L=150mL,D正确;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
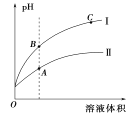
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-