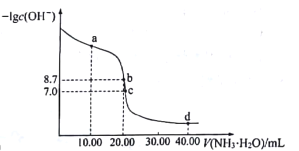
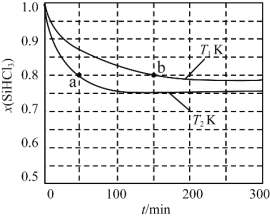
题目内容
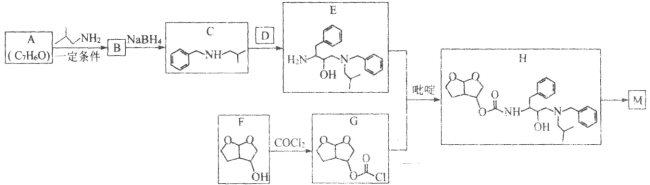
【题目】化合物M(![]() )是一种能有效抑制新型冠状病毒复制的药物中间体。实验室以芳香化合物A为原料制备M的一种合成路线如图所示:
)是一种能有效抑制新型冠状病毒复制的药物中间体。实验室以芳香化合物A为原料制备M的一种合成路线如图所示:
已知:①![]() R1
R1![]() N
N![]() R2(R1、R2表示氢原子或烃基)
R2(R1、R2表示氢原子或烃基)
②![]()
![]() NR1R2
NR1R2
请回答:
(1)A的化学名称为______________;B的结构简式为______________;D中含氧官能团的名称为______________。
(2)F→G的化学方程式为______________。
(3)由E和G生成H的反应类型为______________;吡啶是一种有机碱,该反应中加入吡啶的作用为______________。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。M中含有手性碳原子的数目为______________。
(5)C的同分异构体中,属于芳香族化合物且核磁共振氢谱中有4组峰的结构简式为______________(任写2种即可)。
(6)写出用乙醇和乙胺(CH3CH2NH2)为原料制备化合物![]() NH
NH![]() 的合成路线______________(其他无机试剂任选)。
的合成路线______________(其他无机试剂任选)。
【答案】苯甲醛 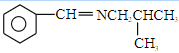 羟基
羟基 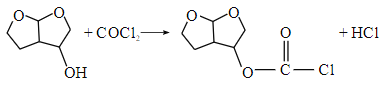 取代反应 中和取代生成
取代反应 中和取代生成 ![]() ,从而使有机反应平衡右移,提高产率 4
,从而使有机反应平衡右移,提高产率 4 
![]()
【解析】
(1)![]() 的分子式为
的分子式为 ![]() ,结合
,结合 ![]() 的结构可知
的结构可知 ![]() 中含有苯环,故
中含有苯环,故 ![]() 为
为![]()
![]() 。根据已知信息①,
。根据已知信息①,![]() 与
与
![]() 一定条件下生成
一定条件下生成 ![]() ,故
,故 ![]() 结构为:
结构为:
![]() ,根据
,根据 ![]() 、
、![]() 结构及已知信息②可得:
结构及已知信息②可得:![]() 结构为:
结构为: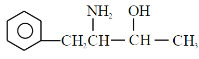
![]() ,其含氧官能团为羟基。
,其含氧官能团为羟基。
(2)![]() 与
与 ![]() 取代反应生成
取代反应生成 ![]() ,则
,则 ![]() 的反应原理为:
的反应原理为:
![]() 。
。
(3)根据 ![]() 、
、![]() 和
和 ![]() 的结构可知:
的结构可知:![]() 与
与 ![]() 取代反应生成
取代反应生成 ![]() 和
和 ![]() ,故反应类型为:取代反应,吡啶为一种有机碱,可以中和取代生成
,故反应类型为:取代反应,吡啶为一种有机碱,可以中和取代生成 ![]() ,从而使有机反应平衡右移,提高产率。
,从而使有机反应平衡右移,提高产率。
(4)![]() 的结构简式为:
的结构简式为: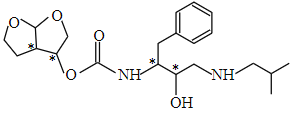
![]() (* 标记的摊位手性碳原子),所以有
(* 标记的摊位手性碳原子),所以有 ![]() 个手性碳原子。
个手性碳原子。
(5)![]() 为
为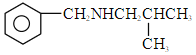
![]() ,其同分异构体为芳香族化合物,说明含有苯环结构;核磁共振氢谱有
,其同分异构体为芳香族化合物,说明含有苯环结构;核磁共振氢谱有 ![]() 组峰,说明有
组峰,说明有 ![]() 种类型的氢原子,所以符合条件结构为:
种类型的氢原子,所以符合条件结构为: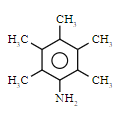
![]() ,
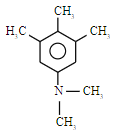
,
![]() ,
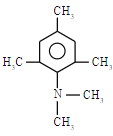
,
![]() 。
。
(6)![]() 催化氧化可以生产
催化氧化可以生产 ![]() ;根据已知信息①,
;根据已知信息①,![]() 与
与 ![]() 一定条件下生成
一定条件下生成 ![]() ;根据
;根据 ![]() 还原生成
还原生成 ![]() 的反应原理,
的反应原理,![]() 在
在 ![]() 条件下还原生成
条件下还原生成 ![]() 。故合成路线为:
。故合成路线为:![]() 。
。

【题目】已知:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1200 kJ·mol1。在2 L恒容密闭容器中,按照下表中甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%。下列说法中正确的是
甲 | 乙 |
0.2 mol NO2 | 0.1 mol NO2 |
0.4 mol CO | 0.2 mol CO |
A.放热反应,一定能自发进行
B.该温度下,反应的平衡常数为5
C.达平衡时,NO2的浓度:甲>乙
D.达平衡时,N2的体积分数:甲<乙
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
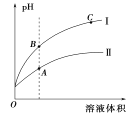
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-