��Ŀ����
����Ŀ��һ�ּ״�ȼ�ϵ�ز��ò����缫����,����е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ����ʾ��ͼ:

��ش���������:
��1��Pt(a)�缫��ӦΪ________;����õ�ع���ʱ��·��ͨ��2mol����,�����ĵ�CH3OH��________mol��
��2��þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ��������ͼ3Ϊ��þ������������ȼ�ϵ��ԭ��ʾ��ͼ,�缫Ϊþ�Ͻ�Ͳ��Ͻ�EΪ��ȼ�ϵ�ص�________(����������������)����F�缫�ϵĵ缫��Ӧʽ________��

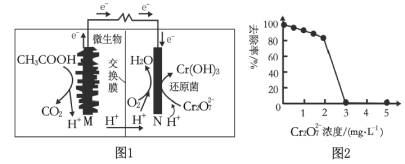
��3����ȩ��(HOOC��CHO)���л��ϳɵ���Ҫ�м��塣��ҵ������˫���ҳɶԵ�ⷨ��������ȩ��,ԭ����ͼ4��ʾ,��װ��������������Ϊ���Ե缫,�����Ҿ��ɲ�����ȩ��,�����Ҷ�ȩ(OHC��CHO)��M�缫�IJ��ﷴӦ������ȩ�ᡣ

��N�缫�ϵĵ缫��ӦʽΪ________��
����2molH+ͨ�����ӽ���Ĥ,����ȫ�����˷�Ӧ,���װ�������ɵ���ȩ��Ϊ________mol��
���𰸡�CH3OH+H2O-6e-CO2��+6H+ ![]() �� ClO-+2e��+H2OCl-+2OH�� HOOC��COOH+2e��+2H+=HOOC-CHO+H2O 2
�� ClO-+2e��+H2OCl-+2OH�� HOOC��COOH+2e��+2H+=HOOC-CHO+H2O 2
��������
(1)ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ������������ʧȥ���ӷ���������Ӧ������������ԭ��Ӧ��ʧ���ӹ��ɽ��м��㣻
(2)��ʾ��ͼ��֪����þ������������ȼ�ϵ����ʧ���ӵ�Ϊ��������þ�Ͻ�Ϊ�������缫��ӦʽΪMg-2e-��2OH-===Mg(OH)2�����Ͻ�Ϊ������������ClO���õ������������ӣ��������ĵ缫��ӦʽΪClO��+2e��+H2O===Cl��+2OH����
(3)����H+���ƶ������֪��M�缫��������Cl-�������Ϸ���ʧ���ӵ�������Ӧ����Cl2���缫��ӦʽΪ2Cl--2e-===Cl2����N�缫Ϊ������HOOC-COOH�������ϵõ��ӷ�����ԭ��Ӧ����HOOC-CHO���缫��ӦʽΪHOOC-COOH+2e-+2H+===HOOC-CHO+H2O��
(1)��װ��ͼ��֪���������ҺΪ������Һ��ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ��������Pt(a)�Ǹ�����ʧȥ���ӷ���������Ӧ���缫��ӦʽΪCH3OH+H2O-6e-CO2��+6H+�����ݵ缫����ʽ��֪����·��ͨ��2mol����ʱ�����ĵ�CH3OH�����ʵ���Ϊ![]() mol���ʴ�Ϊ��CH3OH+H2O-6e-CO2��+6H+��
mol���ʴ�Ϊ��CH3OH+H2O-6e-CO2��+6H+��![]() ��
��
(2)��ʾ��ͼ��֪����þ������������ȼ�ϵ���У�EΪþ�Ͻ�Ϊȼ�ϵ�صĸ�����FΪ���Ͻ�Ϊ������������ClO���õ������������ӣ��������ĵ缫��ӦʽΪClO��+2e��+H2O===Cl��+2OH�����ʴ�Ϊ������ClO-��2e-��H2O===Cl-��2OH-��
(3)��N�缫Ϊ���ص�������HOOC-COOH�������ϵõ��ӷ�����ԭ��Ӧ����HOOC-CHO���缫��ӦʽΪHOOC-COOH+2e-+2H+===HOOC-CHO+H2O���ʴ�Ϊ��HOOC-COOH+2e-+2H+===HOOC-CHO+H2O��
��2mol H+ͨ�����ӽ���Ĥ��������ת��2mol���ӣ����ݵ缫����ʽHOOC-COOH+2e-+2H+===HOOC-CHO+H2O����֪��������1mol��ȩ�������M�����缫��ӦʽΪ2Cl--2e-===Cl2�����Ҷ�ȩ��Cl2�ķ�ӦΪCl2+OHC��CHO+H2O===HOOC��CHO+2HCl���������������������ʧ������ȣ�����Ҳ����1mol��ȩ���������������ȩ�����ɣ��������ɵ���ȩ��Ϊ2mol���ʴ�Ϊ��2��