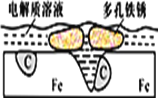
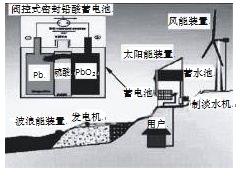
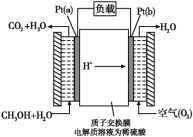
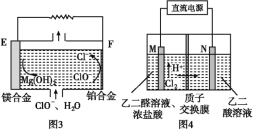
题目内容
【题目】碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
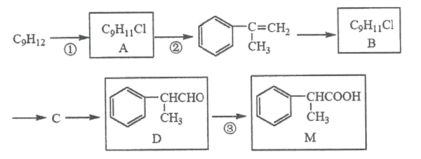
(1)有机物M经过太阳光光照可转化成N,转化过程:
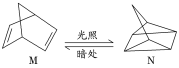
ΔH=+88.6kJ·mol-1。则M、N相比,较稳定的是_____。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为________。
(4)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________。
【答案】M < 98kJ CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.3kJ·mol-1
【解析】
本题主要考查化学反应中能量变化与应用以及热化学方程式的书写。
(1)物质能量越低越稳定;
(2)燃烧热为101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时放出的热量;
(3)先求出转移1mol电子相关物质的反应量,根据参加化学反应的物质的物质的量与反应热一一对应关系求解;
(4)根据盖斯定律写出热化学反应方程式。
(1)由题干信息可知,M转化为N吸收热量,故N的能量高于M,较稳定的为M,故答案为:M;
(2)1mol甲醇完全燃烧生成液态水和二氧化碳放出726.5kJ能量,该热化学反应方程式中生成物H2还可继续燃烧生成液态水并放出能量,即甲醇未完全燃烧,放出的热量小于726.5kJ,则a<726.5,故答案为:<;
(3)由反应可列出相关关系式:4molAl~12mol e-~1176kJ,由此可知,每转移1mol电子放出的热量为![]() ,故答案为98kJ;
,故答案为98kJ;
(4)根据盖斯定律,反应②-反应①即可得一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.3kJ·mol-1,故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.3kJ·mol-1。

 名校课堂系列答案
名校课堂系列答案【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成