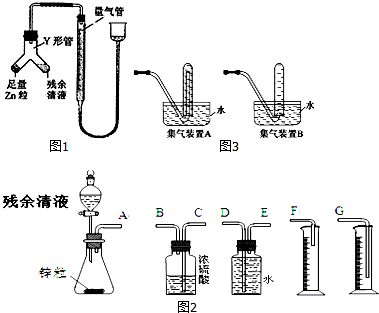
题目内容
1.下图是元素周期表的一部分,针对表中的①~⑩种元素,用元素符号或化学式回答相关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
分析 根据元素在周期表中的位置知,①~⑩种元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素;
(1)这些元素中最不活泼的元素是Ar,其原子核外有18个电子,核外有3个电子层;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)⑤的单质是Al,Al和NaOH溶液反应生成偏铝酸钠和氢气;其氢氧化物是氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠和水;
(4)⑦单质是氯气,③与⑩组成的化合物是NaBr,氯气和NaBr发生置换反应生成溴.
解答 解:根据元素在周期表中的位置知,①~⑩种元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素;
(1)这些元素中最不活泼的元素是Ar,其原子核外有18个电子,核外有3个电子层,原子结构示意图为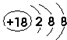 ,故答案为:
,故答案为: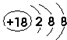 ;
;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,剩余元素中非金属性最强的是Cl元素,则酸性最强的是HClO4;元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性最强的是K,则碱性最强的是KOH,
故答案为:HClO4;KOH;
(3)⑤的单质是Al,Al和NaOH溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;其氢氧化物是氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO2-+2H2O;
(4)⑦单质是氯气,③与⑩组成的化合物是NaBr,氯气和NaBr发生置换反应生成溴,离子方程式为Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2.
点评 本题考查元素周期表结构和元素周期律综合应用,为高频考点,明确原子结构、元素周期律内涵、物质性质即可解答,注意F元素没有最高价氧化物的水化物,为易错点,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Mg>Al>Ca | B. | Al>Na>Li | C. | Al>Mg>Ca | D. | Mg>Ba>Al |
| A. | 将久置的亚硫酸钠溶液中加入氯化钡溶液再加入稀盐酸 | |
| B. | 向碳酸钠溶液中加入酸性氯化钙溶液 | |
| C. | 向亚硫酸钠溶液中通入氯气再加入氯化钡和稀盐酸 | |
| D. | 向亚硫酸钠溶液中加入稀硝酸后再加入氯化钡溶液 | |
| E. | 二氧化硫通入氯化钡溶液中 |
| A. | 5.6g铁粉与氯气充分反应失去的电子数一定为0.3NA | |
| B. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeCl2溶液中通入Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
| A. | 氢气分子内每个氢原子都达到8电子稳定结构 | |
| B. | 相同条件下1mol H2的能量比2mol H的能量低 | |
| C. | 1mol H2离解成2mol H要放出437.6kJ热量 | |
| D. | 氢原子比氢分子性质更稳定 |
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.