题目内容
10. 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.(1)Li3N晶体中氮以N3-存在,基态N3-的核外电子排布式为1s22s22p6.
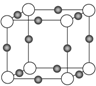
(2)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示.X的元素符号是Cu,与同一个N3-相连的X+有6个.
分析 (1)基态N3-的核外有10个电子,根据构造原理书写电子排布式;
(2)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,该晶胞中白色小球=8×$\frac{1}{8}$=1,黑色小球=12×$\frac{1}{4}$=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,根据晶胞结构图可判断与同一个N3-相连的X+的数目.
解答 解:(1)基态N3-的核外有10个电子,根据构造原理书写电子排布式为1s22s22p6,
故答案为:1s22s22p6;
(2)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,该晶胞中白色小球=8×$\frac{1}{8}$=1,黑色小球=12×$\frac{1}{4}$=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,同一个N3-相连的Cu+有6个,
故答案为:Cu;6.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布等知识点,侧重考查知识迁移及空间想象能力,易错点是配位数的计算,题目难度不大.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
1.下列实验装置图完全正确的是( )
| A. | 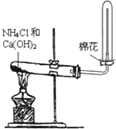 实验室制取并收集氨气 | B. | 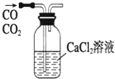 除去CO中混有的CO2 | ||
| C. | 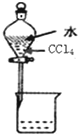 分离水和CCl4的混合物 | D. | 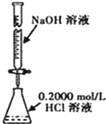 酸碱中和滴定 |
5.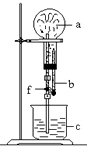 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )
 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO | NaOH溶液 |
| B | Cl2 | 饱和NaCl溶液 |
| C | CO2 | KOH溶液 |
| D | NO2 | 水溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.下图是元素周期表的一部分,针对表中的①~⑩种元素,用元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为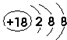 .
.
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
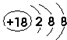 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
2.下列物质的水溶液中,加入Ba(OH)2溶液后,原溶液中阴、阳离子都减少的是( )
| A. | CuSO4 | B. | Ca(NO3)2 | C. | Na2CO3 | D. | FeCl3 |
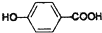
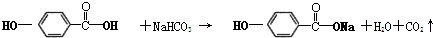 ,
,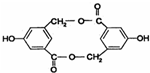 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.
,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.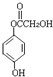 等(只写一种).
等(只写一种).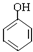 .
.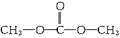 .
.
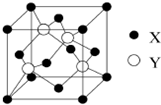 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.