题目内容
7.下列反应中一定有白色沉淀生成的是( )| A. | 将久置的亚硫酸钠溶液中加入氯化钡溶液再加入稀盐酸 | |
| B. | 向碳酸钠溶液中加入酸性氯化钙溶液 | |
| C. | 向亚硫酸钠溶液中通入氯气再加入氯化钡和稀盐酸 | |
| D. | 向亚硫酸钠溶液中加入稀硝酸后再加入氯化钡溶液 | |
| E. | 二氧化硫通入氯化钡溶液中 |
分析 A、亚硫酸钠易被空气氧化成硫酸钠,加入氯化钡溶液生成不溶于稀盐酸的硫酸钡;
B、向碳酸钠溶液中加入酸性氯化钙溶液,酸性条件下不可能生成碳酸钙沉淀;
C、亚硫酸钠溶液被氯气氧化成硫酸钠和氯化钡发生复分解反应生成硫酸钡;
D、向亚硫酸钠溶液中加入稀硝酸后,硝酸氧化亚硫酸钠,生成硫酸盐,再向溶液中加入氯化钡溶液,生成不溶于硝酸的硫酸钡;
E、二氧化硫通入氯化钡溶液中,弱酸不能制强酸.
解答 解:A、亚硫酸钠易被空气氧化成硫酸钠,加入氯化钡溶液生成不溶于稀盐酸的硫酸钡,所以一定有白色沉淀生成,故正确;
B、向碳酸钠溶液中加入酸性氯化钙溶液,酸性条件下不可能生成碳酸钙沉淀,故错误;
C、亚硫酸钠溶液被氯气氧化成硫酸钠和氯化钡发生复分解反应生成硫酸钡,所以一定有白色沉淀生成,故正确;
D、向亚硫酸钠溶液中加入稀硝酸后,硝酸氧化亚硫酸钠,生成硫酸盐,再向溶液中加入氯化钡溶液,生成不溶于硝酸的硫酸钡,所以一定有白色沉淀生成,故正确;
E、二氧化硫通入氯化钡溶液中,弱酸不能制强酸,不反应,故错误;
故选:ACD.
点评 本题考查亚硫酸钠的性质,亚硫酸盐具有还原性易被氧化剂氧化生成硫酸盐,比较容易.

练习册系列答案
相关题目
17.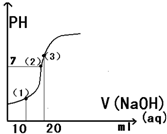 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )| A. | 点(1)所示溶液中:C(CH3COOH)+C(H+)=C(CH3COO-)+C(OH-) | |
| B. | 点(2)所示溶液中:C(Na+)=C(CH3COO H )+C(CH3COO-) | |
| C. | 点(3)所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+) | |
| D. | 滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) |
12.下列操作中,所用仪器合理的是( )
| A. | 用托盘天平称量5.22g食盐 | |
| B. | 用100mL的量筒取5.2mL稀盐酸 | |
| C. | 用100mL的容量瓶配置50mL 0.1mol/L盐酸 | |
| D. | 用25mL的酸式滴定管量取15.12mL高锰酸钾溶液 |
1.下图是元素周期表的一部分,针对表中的①~⑩种元素,用元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为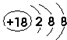 .
.
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
18.下列各组物质中,既都含有共价键,却又都不属于共价化合物的一组是( )
| A. | Na2O2 Na2O | B. | KClO NaOH | C. | Br2 HBr | D. | HF H2O |
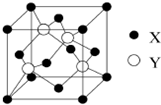 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.